
|
Читайте также: |
Биогенные элементы - элементы необходимые для построения и жизнедеятельности клеток и организмов.
Al, O, N, S, P, С, Са, Mg, К, Na, Сl, I, Mn, Со, Те, Мо, V, Fe, Sb, Br, F, Li
Среди них наблюдают «10 металлов жизни»: Са, Mg, К, Na – I остов десятки сотни г, Fe, Со, Mn, Сu, Zn, Мо – II остов десятки доли г
Zn – поджелудочная железа, половые органы, гипофиз
I – щитовидная железа
F – эмаль зубов
Аs, Аl, V – волосы, ногти
Са, Нg, Мb – почки
Мn, Сr, Вr – гипофиз
Макроэлементы – галогены – составляющие белков, нуклеиновых кислот, углеводов, липидов. Органогены: О, С, Н, Р, S, N
Р – твердые ткани зубов в виде гидроксиолатитов
В организме человека поддерживается баланс оптимальной концентрации биогенных элементов – гомеостаз. Нарушение этого баланса приводит к различным заболеваниям.
53. Классификация химических элементов в организме по Вернадскому. Роль макро – и микро- элементов в живом организме. Концентрирование химических элементов в органах, тканях и биожидкостях человека. Эндемические элементы.
В зависимости от среды содержания элементов в живых организмах Вернадский разделил их на 3 группы:
1. Макроэлементы: 10-2% в организме, к ним относят О, С, Н, N, P, S – органогены, Са, Мg,Na, K, Li
2. Микроэлементы: 10-3 – 10-5% в пределах Zn, Cr, Su, Se, l, Cu, As, F, Br, Co, Fe, Mo
Входят в состав ферментов, гормонов, витаминов, биологически активных веществ в качестве комплексообразователя; участвуют в обмене веществ, процессах размножения, тканевом дыхании; участвуют в ОВР.
Влияют на процесс кроветворения, проницаемость сосудов и тканей.
3. Ультрамикроэлементы – не превысят 10-5% Hg, Au, То, Ra, Аl, U, Ni, В, V, Ва
Макроэлементы – галогены – составляющие белков, нуклеиновых кислот, углеводов, липидов. Органогены: О, С, Н, Р, S, N
Р – твердые ткани зубов в виде гидроксиолатитов.
Са – в костной и зубной ткани
NaCl – во внеклеточных областях
К, Мg – во внутриклеточных областях
Мg – твердые ткани зубов в виде Мg3(PO4)2
К, Na – в виде фторидов, в состав костной ткани
В организме человека поддерживается баланс оптимальной концентрации биогенных элементов – гомеостаз. Нарушение этого баланса приводит к различным заболеваниям.
F – кариес
I – эндемические заболевания
Эндемические заболевания: с аномалиями содержания некоторых элементов в почве, водоемах, той или иной биологической зоны.
Общая характеристика s-элементов. Валентные электроны. Изменение активности s-элементов в группе. Степень окисления. Щелочные металлы, их химические свойства. Особенности свойств лития. Оксиды, пероксиды, надпероксиды щелочных металлов. Биологическая роль натрия и калия. Натрий-калиевый насос. Соединения щелочных металлов, применяемых в медицине.
Находятся в Iа и IIа групп главной подгруппы, а также Не.
Валентными являются s-электроны. ns1 – I группа Н, Li, Na, Rb, Cs, Fe
ns2 – II группа Be и щелочноземельные металлы: Mg, Са, Sr, Ва, Ra
Свойства щелочных металлов: сверху вниз
Радиус атомов в Iа подгруппе увеличивается
Энергия ионизации уменьшается
Сверху вниз растет активность. Исходя из строения атомы Iа группы проявляется степень окисления = +1, все металлы – восстановители, а их ионы в степени окисления +1 будут окислителями.
Li – проявляет стабильную степень окисления = +1 тем не менее из-за наличия 2р оболочки. Химия Li отличается от химии его соседей по группе
Li+1 – лучший комплексообразователь
Все щелочные металлы энергично соединяются с кислородом, только Li образует оксид лития, а остальные металлы дают пероксиды и надпероксиды.
Химические свойства:
1. Взаимодействие с кислородом:
4Li + O2  2Li2O
2Li2O
2Na + O2  Na2O2
Na2O2
К + O2  КO2
КO2
Пероксиды и надпероксиды являются солями сильных оснований и слабых кислот => подвергаются гидролизу
Na2O2 +Н2О  2NaOH + Н2О2
2NaOH + Н2О2
КО2 + Н2О  2КОН + Н2О2 + О2
2КОН + Н2О2 + О2 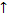
Пероксиды и надпероксиды сильные окислители используются для получения кислорода на космических кораблях и подводных лодках.
2. Взаимодействие с водой:
2Li + 2Н2О  2LiОН + Н2
2LiОН + Н2 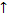
3. Взаимодействие с кислотами
4. Взаимодействие с водородом
5. Взаимодействие с галогенами
Все соли щелочных металлов растворимы в воде, только литий образует плохорастворимые соли: Li3PO4, Li2CO3, LiF
Концентрация ионов натрия внутри клетки в 15раз меньше, чем во внеклеточной жидкости, а концентрация ионов калия в 35 раз больше внутри клетки, чем вне её.
Натрий-калиевый раствор обеспечивает перенос ионов, через плазматическую мембрану, против градиента концентрации за счет гидролиза 1 молекулы АТФ, 3 иона натрия выводят из клетки, а 2 иона калия поставляет внутрь клетки. Этот дисбаланс электрических зарядов служит при чиной возникновения разности потенциалов на плазматической мембране. Внутренняя сторона мембраны заряжена отрицательно по отношению к внешней поверхности мембраны.
Na+ - необходим для сокращения мышц
К+ - способствует расслаблению
Избыток Na+ - гипертония, отеки
Na+ - участвует в поддержании соматического давления(гомеостаза), обеспечивает кислотно-основное равновесие, регулирует водный обмен. Регулирует рН внутренней среды организма, участвует в передаче нервных импульсов через мембраны нервных клеток.
К+ - распространен в печени, почках, сердце, крови, море: участвует в функционировании сердца, проведении нервных импульсов, участвует в обменных реакциях.
Недостаток К – мышечная слабость, раздражительность, спазмы мышц
Избыток К – возбуждение ЦНС, маниакальное состояние причина остановки сердца
NaCl – используют дл промывания желудка, очистки гнойных ран, при отравлении Ag+
Li – в печени, почках, селезенке, легких, молоке, мышцах. Оказывает положительное влияние на больных с маниакальной депрессией, снижает эмоциональное напряжение (Li2CO3)
NaHCO3 – при ацидозе, сахарном диабете, повышает кислотность желудочного сока, при воспалительных заболеваниях глаз, горла, за счет выделяющейся щелочи
КСl – уменьшает возбудимость сердечной мышцы
Na2SO4*10 Н2О – глауберова соль – расслабляющее средство
S-элементов llа группы. Степени окисления. Тип гибридизации атомных орбиталей. Щелочноземельные элементы. Особенности свойств бериллия. Биологическая роль ионов магния и кальция. Антагонизм ионов магния и кальция. Соединения магния и кальция, применяемы в медицине.
Степень окисления +2 Ве, Mg, Са, Sr, Ва, Ra
sp-гибридизация
Ca, Sr, Ве – проявляют большие сходства между собой и называются щелочноземельными
Ве – «стоит особняком» из-за наличия гелиевого экрана
Амфотерность Ве:
ВеО + 2НСl  ВеСl2 + Н2О
ВеСl2 + Н2О
ВеО + 2NaOH + Н2О  Na2[Ве(ОН)4]
Na2[Ве(ОН)4]
При сплавлении ВеО + 2КOH  К2ВеО2 + Н2О
К2ВеО2 + Н2О
Са+2 – регулятор внутриклеточных процессов: сокращение мышц, регуляции сердечного ритма, передача нервного импульса, участвует в свертывании крови, влияет на кислотно-основный баланс, оказывает влияние на активность эндокринной системы. Противовоспалительное действие.
Избыток Са+2 – опасность остановки сердца, увеличивается свертываемость крови
Mg+2 – биологические антагонисты ионов Са+2: поддерживает осмотическое давление внутри клеток; образует комплекс с АТФ, белками; входит в состав ферментов; с их участием формируются рибосомы, активируется процесс синтеза белка; способствует понижению артериального давления крови; усиливает перестатику кишечника; усиливает секрецию желчи.
Са(С6Н11О6)2 – глюконат кальция – восполнение недостатка кальция
СаСl2*6Н2О – кровеостанавливающее, противовоспалительное действие, антидот при отравлениях солями магния
СаСО3 – антоцидное средство, при повышении кислотности желудочного сока
МgO – «жженая магнезия» - антоцидное средство при повышенной кислотности желудочного сока
МgO с МgO2 – «магний перекись» 85% и 15% антоцидное и бактериальное средство
MgSO4*Н2О – «горькая соль» - успокаивающее, снотворное, слабительное средство
Mg(ОН)2*MgCO3*H2О – «белая магнезия» - антоцидное, легкое слабительное средство
Дата добавления: 2015-07-11; просмотров: 279 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Внутрикомплексные соединения. Строение и типы связей в молекуле внутрикомплексных соединений. | | | Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока. |