Буферная емкость. Влияние добавления или щелочи на pH среды буферных систем. Буферная емкость по кислоте(Ва) и по щелочи(Вв). Факторы, определяющие буферную емкость.
Применение второго начала ТД к живым организмам. Математическое выражение 2 начала ТД для открытых систем. | Энергия Гиббса как функция состояния системы и критерий направленности процесса. | Закон действующих масс для химического равновесия. Константа химического равновесия, способы ее выражения. Прогнозирование смещения химического равновесия. | Понятие о стационарном состоянии живого организма, его характеристики. Сходство и отличие стационарного состояния от химического равновесия. Гомеостаз и адаптация организма. | Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр. | Законы Генри, Дальтона, Сеченова. Применение этих законов при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови. | Нарушение кислотно-щелочного равновесия. Ацидоз, алкалоз. Способы их устранения. | Влияние концентрации на скорость химической реакции. Закон действующих масс. | Зависимость скорости реакции от температуры. Правило Вант-Гоффа. | Теория активных соударений Аррениуса. Энергия активации. Уравнение Аррениуса в экспоненциальном и дифференциальном виде. Связь величины энергии активации со скоростью реакции. |
Буферная емкость – равна количеству вещества сильной кислоты или сильного основания, которое следует добавить к одному л буферного раствора, что бы изменить значение pH 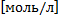
Буферная ёмкость по кислоте:Буферная емкость по основанию:
Ва=  =
= 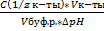 Вв=
Вв=  =
= 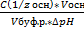
n(1/z к-ты) и n(1/zосн) – количество эквивалента кислоты и основания (моль)
С(1/z к-ты) и С(1/z осн) – молярная концентрация эквивалента кислоты и основания
∆ pH = pH0 – pH
pH0 и pH – значения pH буферного раствора до и после добавления кислоты или щелочи
Буферная емкость зависит от факторов:
1. Чем больше количество компонентов кислотно-основной пары (основание/сопряженная к-та), тем выше буферная емкость раствора
 =1 maxB
=1 maxB
2. Буферная емкость зависит от pH буферного раствора
Дата добавления: 2015-07-11; просмотров: 269 | Нарушение авторских прав
mybiblioteka.su - 2015-2024 год. (0.006 сек.)

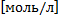
 =
= 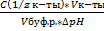 Вв=
Вв=  =
= 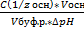
 =1 maxB
=1 maxB