
| Рисунок 1. Платина |
 Установлено, что активность катализатора в значительной степени зависит от метода его приготовления и очевидно условия, при которых он получается, значительно влияют на его физико-химические свойства. Такими свойствами являются: состояние поверхности и строение катализатора.
Установлено, что активность катализатора в значительной степени зависит от метода его приготовления и очевидно условия, при которых он получается, значительно влияют на его физико-химические свойства. Такими свойствами являются: состояние поверхности и строение катализатора.
Важное значение имеет не только метод приготовления катализатора, но и его форма. Активность платины зависит от формы, в которой она применяется, т. е. применяется ли в виде порошка, платиновой черни, губчатой платины, платинированного асбеста или платиновой проволоки. Метод приготовления определяет степень дисперсности катализаторов платиновой группы, а также и степень их активности.
Большое внимание было уделено изучению физического состояния катализаторов платиновой группы. Адамс, Вурхис и Шрайнер указывают, что при получении платиновой черни особо важными физическими факторами являются: температура; среда, в которой производится восстановление окиси платины в платиновую чернь, и тормозящее действие следов неорганических солей и отработанных растворителей.
Платинового катализатор получают из щелочного раствора соли путем электролиза. Осадок образующейся на аноде сложной соли окиси платины, например 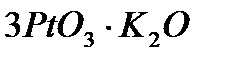 , обрабатывают уксусной кислотой, для превращения в
, обрабатывают уксусной кислотой, для превращения в 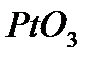 ,а затем восстанавливают до
,а затем восстанавливают до 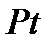 .
.
Рисунок 2. Палладий
 3.2. Палладий
3.2. Палладий
Каталитическая активность палладия зависит от условий его приготовления и условий, при которых ведутся каталитические реакции. Эти условия могут быть благоприятными и способствовать каталитической активности или, наоборот, тормозить ее. Если нагреть губчатый палладий на воздухе, поверхность сероватого блестящего металла становится черной вследствие образования недокиси, энергично адсорбирующей водород при обыкновенной температуре и окисляющей его до воды; этот процесс сопровождается разогреванием металла.
Фрицман, рассматривая каталитическую активность водородистого палладия, указывает, что в соединениях с палладием водород имеет необычную валентность 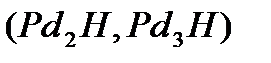 вследствие перехода в металлическое состояние. Легкость разложения этих соединений и их способность к образованию продуктов присоединения делает их особенно подходящими для применения при синтезе и при восстановлении, а присутствие радикалов и водородных атомов придает им высокую активность.
вследствие перехода в металлическое состояние. Легкость разложения этих соединений и их способность к образованию продуктов присоединения делает их особенно подходящими для применения при синтезе и при восстановлении, а присутствие радикалов и водородных атомов придает им высокую активность.
Палладий, как и платина, часто применяют на носителях. Так как адсорбционная способность катализатора по отношению к водороду зависит в основном от применяемого носителя, а не от вида осажденного палладия, то активность катализатора зависит от степени адсорбции восстанавливаемого соединения носителем палладия перед его восстановлением и от характера распределения металлического катализатора по его поверхности.
Способ получения активного палладиевого катализатора заключается в механическом раздроблении компактного металлического палладия, химической очистки получающейся поверхности, многократном насыщении водородом при температуре ниже 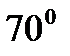 до отношения, соответствующего примерно
до отношения, соответствующего примерно 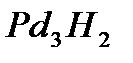 по весу, и в удалении адсорбированного водорода нагреванием. Утверждают, что полученный таким образом палладиевый катализатор очень стабилен, но чувствителен к контактным ядам, он очень подходит для окисления аммиака.
по весу, и в удалении адсорбированного водорода нагреванием. Утверждают, что полученный таким образом палладиевый катализатор очень стабилен, но чувствителен к контактным ядам, он очень подходит для окисления аммиака.
Никель
| Рисунок 3. Никель |
 Неоднократно подчеркивалось, что каталитическая активность никеля зависит от способа его приготовления; в некоторых случаях окись более активна, в других – менее активна, чем металл. Как показывает цвет катализатора, свойства поверхности изменяются в зависимости от температуры восстановления. Никель, приготовленный при
Неоднократно подчеркивалось, что каталитическая активность никеля зависит от способа его приготовления; в некоторых случаях окись более активна, в других – менее активна, чем металл. Как показывает цвет катализатора, свойства поверхности изменяются в зависимости от температуры восстановления. Никель, приготовленный при 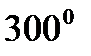 , имеет черный цвет и высокоразвитую поверхность и является соответственно весьма хорошим катализатором, тогда как никель, приготовленный при
, имеет черный цвет и высокоразвитую поверхность и является соответственно весьма хорошим катализатором, тогда как никель, приготовленный при 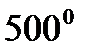 , серый с белым металлическим блеском и совсем не пригоден для катализа.
, серый с белым металлическим блеском и совсем не пригоден для катализа.
Сабатье и Мейль считали, что каталитические свойства окиси никеля при окислении углеводородов сравнимы со свойствами тонко размельченной платины. Высшие оксиды – полуторная окись никеля и двуокись никеля – получаются путем анодного окисления ил действием гипогалогенидов щелочных металлов на металл или его соли.
Особенно подходящий катализатор для гидрогенизации ненасыщенных органических соединений получается, если нагревать азотнокислый никель с солью никеля, образованной органической кислотой.
Никелевый катализатор, широко применяемы при гидрогенизации жиров и в заводских процессах органического синтеза, готовится измельчением никель-алюминиевого сплава и затем выщелачивания раствором едкого нитра или углекислого натрия всего или части алюминия.
Хорошим катализатором является также продукт, полученный превращением растворимой соли никеля сперва в нерастворимое соединение никеля, а затем в муравьинокислый никель путем добавления муравьиной кислоты.
При приготовлении никелевых катализаторов следует учитывать влияние спекания металла. Добавкой к катализатору некоторых веществ можно замедлить спекание при высоких температурах; таким веществом является, например, окись алюминия в отношении окиси никеля.
Дата добавления: 2015-08-17; просмотров: 224 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 3. Активность и приготовление катализаторов | | | Алюминий |