
|
Читайте также: |
Катализ – процесс увеличения скорости химической реакции при участии катализаторов. Катализаторами могут быть вещества в состоянии атомов, молекул, ионов или поверхности раздела фаз, которые взаимодействуют с исходными химическими соединениями, уменьшают энергию активации, резко увеличивают скорость реакции и выделяются на последующих стадиях в химически неизменном виде. Вещества, которые не ускоряют, а замедляют реакцию (увеличивают энергию активации), называют ингибиторами.
Впервые явление катализа было открыто в 1806 г. Н. Клеманом и Ш. Дезормом в камерном процессе получения серной кислоты. Они установили каталитическое действие оксидов азота на скорость окисления
 . В конце 19 в. промышленным методом получения серной кислоты стал контактный способ, основанный на окислении
. В конце 19 в. промышленным методом получения серной кислоты стал контактный способ, основанный на окислении  кислородом в присутствии платинового катализатора [4].
кислородом в присутствии платинового катализатора [4].
В зависимости от фазового состояния реагирующих веществ и катализатора различают два вида катализа – гомогенный и гетерогенный. Если реагенты и катализатор находятся в одинаковом агрегатном состоянии и между ними нет поверхностей раздела, то катали – гомогенный. При гетерогенном катализе реакция протекает на поверхности раздела двух фаз, одна из которых является катализатором [3].
Каталитические реакции бывают одностадийными (слитными) и многостадийными, проходящими через последовательные стадии, из которых одна является лимитирующей, т. е. стадией с наименьшей скоростью. Рассмотрим слитный механизм каталитического процесса на примере бимолекулярной реакции:
 ,
,
где X – катализатор;  - активированный комплекс. Скорость этой реакции
- активированный комплекс. Скорость этой реакции  , где СX –концентрация катализатора. Этот же процесс можно записать, опустив переходное состояние
, где СX –концентрация катализатора. Этот же процесс можно записать, опустив переходное состояние 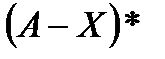 :
:

Константа скорости такой каталитической реакции может быть существенно больше константы той же реакции в отсутствие катализатора из-за уменьшения энергии активации.
В случае двустадийной реакции:
 (первая стадия);
(первая стадия);
 (вторая стадия).
(вторая стадия).
Если  , то осуществляется первая стадия в режиме, похожем на равновесный (двусторонняя реакция). Поэтому её можно охарактеризовать константой равновесия
, то осуществляется первая стадия в режиме, похожем на равновесный (двусторонняя реакция). Поэтому её можно охарактеризовать константой равновесия
 . (1.1)
. (1.1)
Скорость второй односторонней стадии равна
 . (1.2)
. (1.2)
Объединив выражения (1.1) и (1.2), получаем
 .
.
Вещество AX, которое иногда называют промежуточным веществом Аррениуса, реально существует, его можно экспериментально определить методом спектрального анализа. Обычно концентрация этого вещества мала (в этом случае мало значение константы К), что и делает вторую стадию замедленной, лимитирующей. Подобная форма записи многостадийной реакции является достаточно общей, она обязательно включает произведение такого числа констант, которое равно числу стадий. Рассмотрим наиболее характерные особенности гомогенно- и гетерогенно-каталитических реакций.
Дата добавления: 2015-08-17; просмотров: 68 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Введение | | | Гомогенно- и гетерогенно-каталитические процессы |