
Читайте также:
|
Биолюминесценция представляет собой довольно интенсивное свечение, наблюдаемое у ряда биологических объектов и связанное с наличием специализированных ферментных систем, специально предназначенных для генерации квантов света. Классическим примером такой ферментной системы является люциферин-люциферазная светляков. Излучение квантов хемилюминесценции в ходе работы этой системы происходит вследствие окисления специального вещества – люциферина (D-2-(6’-окси-2-бензотиазолил)-D2-тиазолин-4-карбоновая кислота) который затем восстанавливается под действием фермента люциферазы. Схема процессов, протекающих в ходе функционирования люциферин-люциферазной системы светляков, представлена на рис. 26.

Рисунок 26. Схема процессов, определяющих генерацию биолюминесценции у светляков. R1 – оксибензотиазиновая группа люциферина; ЛФ – люцифераза; АД – аденозин. В целях упрощения некоторые атомы водорода не указаны.
Публикуется с модификациями по: Рощупкин Д.И., Артюхов В.Г. Основы фотобиофизики: Учебное пособие. Воронеж: ВГУ, 1997, с. 30.
Поскольку излучение квантов означает, что испускающая их система теряет энергию, длительное свечение возможно при условии восполнения тем или иным образом теряемой энергии. В случае биолюминесценции восполнение энергии, теряемой с квантами свечения, происходит с помощью аденозинтрифосфата (АТФ). В отсутствие этого макроэргического соединения свечение люциферин-люциферазной системы быстро затухает. Если же окисление люциферина протекает с достаточной скоростью, квантовый выход свечения оказывается очень высок – квант хемилюминесценции испускается 4 окисленными молекулами люциферина из каждых 5 образовавшихся. Генерируемая при функционировании люциферин-люциферазной системы хемилюминесценция располагается в видимой области спектра (500-650 нм), а максимум излучения приходится на 550-575 нм (в зависимости от вида светляка). Интересно, что положение максимума в спектре люциферин-люциферазной системы определяется видом светляка, люцифераза которого используется. Это дает основания полагать, что спектр излучения меняется вследствие различий в свойствах комплекса возбужденного продукта окисления люциферина с конкретной люциферазой.
Выраженная зависимость люциферин-люциферазной биолюминесценции от количества доступных макроэргических соединений (АТФ, ГТФ и т.д.) в образце позволяет применять анализ этого вида свечения для точного определения содержания таких соединений в исследуемом образце. В настоящее время доступны различные синтетические субстраты с ковалентно присоединёнными к ним молекулами АТФ. Распад этих субстратов при тех или иных условиях сопровождается высвобождением этого макроэргического вещества в среду в свободном виде. В присутствии люциферина и люциферазы при таком распаде будет выявляться весьма яркое свечение объекта, по кинетике которого можно оценить, например, эффективность функции разрушающего синтетический субстрат фермента. Возможны и иные варианты использования подобных субстратов.
Другой пример биолюминесценции – свечение некоторых видов бактерий. Биолюминесценция бактерий связана с окислением 2 основных субстратов: восстановленного флавинмононуклеотида (ФМН*Н2) и длинноцепочечного алифатического альдегида (например, миристинового С12Н12СНО). Схема процессов, приводящих к генерации квантов биолюминесценции у бактерий, приведена на рис. 27.
Квантовые выходы генерации квантов биолюминесценции у бактерий гораздо ниже, чем у люциферин-люциферазной системы светляков и лежат в интервале от 0,04 до 0,17. Спектр излучения расположен в спектральной области 430-600 нм, а спектральное положение максимума испускания зависит от вида бактерии. Обычно этот максимум находится в интервале от 472 до 545 нм.
Биохемилюминесценция (сверхслабое свечение) – низкоинтенсивное (с интенсивностью порядка 103 квант/см2/с) свечение тканей и клеток, не связанное с наличием специализированных ферментных систем. Причиной этой хемилюминесценции является генерация в биологических образцах свободных радикалов (супероксидного радикала, кислорода в синглетном состоянии, гидроксильного радикала, перекисных радикалов и т.д.). Часть продуцируемых радикалов затем рекомбинирует, обуславливая формирование продуктов в электронно-возбужденном состоянии. В качестве примеров свечения данного типа можно привести хемилюминесценцию при перекисном окислении липидов и при активации фагоцитирующих клеток.

Рисунок 26. Схема процессов, определяющих генерацию биолюминесценции у бактерий. R2 и R3 – соответственно, остаток рибитолфосфата и углеводородная часть альдегида; ЛФ – люцифераза. В целях упрощения некоторые атомы водорода не указаны.
Публикуется с модификациями по: Рощупкин Д.И., Артюхов В.Г. Основы фотобиофизики: Учебное пособие. Воронеж: ВГУ, 1997, с. 33.
При перекисном окислении липидов (или, как сейчас часто обозначают этот процесс, липидной пероксидации, от английского «lipid peroxidation») субстратом окисления служат свободные ненасыщенные жирные кислоты или остатки этих кислот в составе липидов (например, фосфолипидов клеточных мембран). Обозначим такой жирнокислотный остаток RH. При отрыве атома водорода в a-положении по отношению к двойной связи с образованием алкильного радикала и последующем присоединении к этому радикалу кислорода происходит перегруппировка алкильной цепи жирной кислоты с формированием диеновой структуры и перекисного радикала этой кислоты ROO·. Кванты биохемилюминесценции генерируются затем вследствие рекомбинации части образовавшихся радикалов ROO·:
ROO· + ROO· ® Р*1 +Р2
Константу скорости этой реакции (реакции квадратичного обрыва цепей окисления) принято обозначать k6. Если квантовый выход излучения квантов хемилюминесценции возбужденным продуктом рекомбинации радикалов ROO· принять равным qхл, то общая интенсивность свечения может быть описана выражением:
|

В этом выражении V – объем образца, 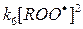 - скорость генерации Р*1 в единице объема.
- скорость генерации Р*1 в единице объема.
Поскольку интенсивность данного типа свечения невысока, при ее регистрации достаточно часто применяют различные активаторы свечения. Наиболее распространенный из них – люминол, механизм действия которого на интенсивность регистрируемой биохемилюминесценции представлен на рис. 27.

Рисунок 27. Механизм активации определяемой перекисным окислением липидов (остатков ненасыщенных жирных кислот) биохемилюминесценции биологических образцов в присутствии люминола. При протекании липидной пероксидации всегда генерируются в некотором количестве гидроксильные радикалы ОН·. Люминол, вступая во взаимодействие с этими радикалами, формирует перекись, образующуюся в электронно-возбужденном состоянии. Затем происходит излучение кванта хемилюминесценции. Поскольку квантовый выход генерации квантов хемилюминесценции у люминола в таких условиях очень высок и намного превышает величину qхл у возбужденного продукта рекомбинации ROO· -радикалов, интенсивность биохемилюминесценции увеличивается.
Публикуется с модификациями по: Рощупкин Д.И., Потапенко А.Я., Клебанов Г.И. Практикум по биофизике. Часть 1. Лабораторные работы по спектральным методам исследования и фотобиологии. М.: 1975, с. 178.
.
Формально люминол, значительно увеличивающий интенсивность регистрируемой биолюминесценции, однако, не относится к ее активаторам. Его и подобные ему соединения (например, люцигенин) выделяют в отдельную группу веществ, обозначаемых как хемилюминесцентные индикаторы.
Собственно активаторы и тушители биохемилюминесценции могут быть условно разделены на 2 большие группы. Это химические и физические тушители и активаторы данного вида свечения. Химические активаторы увеличивают скорость генерации возбужденного продукта Р*1, а химические тушители ее снижают. Как правило, сами эти соединения в образце постепенно расходуются, из-за чего их концентрация со временем падает. Примером химического активатора связанной с липидной пероксидацией биохемилюминесценции могут служить ионы Fe2+ (в концентрации до 10-5 моль/л), а химического тушителя – липидные антиоксиданты, в частности, a-токоферол.
Физические тушители и активаторы биохемилюминесценции на скорость генерации Р*1 не влияют. Механизм их действия на регистрируемую интенсивность данного свечения состоит в том, что их молекулы эффективно перехватывают энергию электронного возбуждения у Р*1. Продукт при этом инактивируется, а молекула тушителя или активатора оказывается в возбужденном состоянии. Если собственный квантовый выход излучательных электронных переходов у этой молекулы оказывается выше, чем у Р*1, в ее присутствии интенсивность свечения будет увеличиваться – т.е. вещество будет активатором биохемилюминесценции. Если же собственный квантовый выход испускания квантов вторичного излучения у таких молекул меньше, чем у Р*1, вещество будет тушителем.
Опишем процессы тушения и активации биохемилюминесценции количественно. Для этого отобразим схему процессов, происходящих в биохемилюминесцирующем образце в присутствии молекул тушителя или активатора.
| (1) | 2RO2·® Р*1 (k6) |
| (2) | Р*1®P+hn1 (k1) |
| (3) | Р*1®P (k2) |
| (4) | Р*1+C®P+C* или P+C (km) |
| (5) | С*®С+hn2 (k1¢) |
| (6) | С*®С (k2¢) |
В этой схеме С – молекулы присутствующего в образце физического тушителя (активатора) биохемилюминесценции, в скобках указаны константы скоростей соответствующих процессов.
Скорость генерации Р*1 (Vг) будет равна:
Vг=k6[RO2·]2
В отсутствие тушителя (активатора) С в системе скорость инактивации Р*1 (Vи) составит:
Vи=k1[Р*1]+k2[Р*1]
В присутствии тушителя (активатора) скорость инактивации Р*1 будет составлять:
V¢и=k1[Р*1]+k2[Р*1]+km[C][Р*1]
В стационарных условиях скорость генерации Р*1 должна быть равна скорости его инактивации. По нашему условию добавление в систему тушителя (активатора) не влияет на скорость генерации Р*1, поскольку введенное соединение является физическим тушителем (активатором). Таким образом, можно записать:
|
k1[Р*1]+k2[Р*1]= k1[Р*1]¢+k2[Р*1]¢+km[C][Р*1]¢,
где [Р*1] и [Р*1]¢ - стационарные концентрации возбужденного продукта Р1 в отсутствие и в присутствии тушителя (активатора) C соответственно.
Введем обозначение:

Использовав его, на основании выражения (105) получим:
|
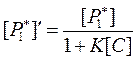
Вспомним, что интенсивность хемилюминесценции в отсутствие тушителя (активатора) равна:

В присутствии же тушителя (активатора) С интенсивность свечения составит:

Величина 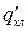 в последнем выражении – квантовый выход свечения Р*1 в присутствии добавки.
в последнем выражении – квантовый выход свечения Р*1 в присутствии добавки.
Очевидно также, что

Отсюда вытекает, что Jхл=[Р*1], а J¢хл=[Р*1]¢. Поэтому мы можем записать:
|

Выражение (107) по своему виду полностью совпадает с ранее приведенным уравнением Штерна-Фольмера (уравнение (83)). Но при его выводе мы не учитывали, что введенное в образец соединение С после возбуждения может само испускать кванты. Поэтому данное выражение применимо для физических тушителей биохемилюминесценции (у которых собственная люминесценция отсутствует или не регистрируется). Величина К в выражении (107) носит название константы тушения. Напомним, что также называется и аналогичная константа в законе Штерна-Фольмера (уравнение (83)).
Если же возбужденная после столкновения с молекулой Р*1 молекула С сама способна с высокой вероятностью испускать кванты излучения, дополнительная интенсивность хемилюминесценции, связанная с присутствием соединения С (JС), будет составлять:
|

В выражении (108) использованы 2 новых обозначения: qC – квантовый выход люминесценции соединения С, и k - коэффициент эффективности соударений молекул С и Р*1, показывающий, какая доля соударений этих молекул приводит к возбуждению молекул С.
Общая же интенсивность хемилюминесценции образца в таком случае будет суммой интенсивностей свечения продукта Р*1 и возбужденных молекул С*:
|

Путем ряда алгебраических преобразований выражение (109) можно привести к виду:
|

Из анализа выражения (110) можно понять, каким образом присутствие вещества С в образце отразится на общей интенсивности хемилюминесценции этого объекта. Если kqC будет меньше qхл (квантового выхода люминесценции Р*1), вещество С будет тушителем – интенсивность свечения в его присутствии упадет. При kqC=qхл интенсивность регистрируемой хемилюминесценции в присутствии С меняться не будет (но измениться ее спектральный состав). Если же kqC>qхл, регистрируемая интенсивность хемилюминесценции J¢хл в присутствии С будет больше исходной Jхл, т.е. в таком случае вещество С будет физическим активатором свечения. Для проверки того, является ли активация хемилюминесценции конкретным веществом процессом физическим, или она связана с увеличением скорости генерации Р*1 в объекте в его присутствии, удобно привести выражение (110) к следующему виду:
|

В выражении (111) постоянная А=kqC/ qхл. Экспериментально же она может быть определена из формулы А=J¢¥/Jхл, где Jхл – интенсивность хемилюминесценции образца в отсутствие С, а J¢¥ - интенсивность хемилюминесценции объекта в присутствии насыщающей (строго говоря, бесконечно большой) концентрации этого активатора. Из выражения (111) следует, что, если в эксперименте зависимость  от концентрации С получается линейной, то вещество С – физический активатор свечения.
от концентрации С получается линейной, то вещество С – физический активатор свечения.
Использование физических активаторов позволяет определить, каков характер электронного возбуждения у продукта Р*1. Для этого нужно применить такой активатор, для которого известны величины km и kqC. Затем экспериментально (по формуле А=J¢¥/Jхл) устанавливается величина А, и строится зависимость  , из которой определяется величина К (см. выражение (111)). Реальное время жизни Р*1 из полученных данных может быть рассчитано по формуле:
, из которой определяется величина К (см. выражение (111)). Реальное время жизни Р*1 из полученных данных может быть рассчитано по формуле:

Квантовый выход люминесценции Р*1 будет равен:

Истинное время жизни Р*1 тогда составит:

Если измеренная величина tи будет порядка 10-8-10-9 секунды, продукт Р*1 находится в состоянии синглетного возбуждения, а если tи окажется больше, то излучение квантов происходит с триплетного уровня Р*1.
Биохемилюминесценция при активации фагоцитирующих клеток. Как уже упоминалось выше, хемилюминесценция обычна при реакциях, связанных с присутствием свободных радикалов. Вместе с тем, в биологических объектах нередко происходит генерация таких радикалов. Например, свободные радикалы генерируются в митохондриях вследствие работы дыхательной цепи. Более того, имеются клетки, у которых имеются специальные ферменты для продукции радикалов кислорода. Это фагоцитирующие клетки, прежде всего, макрофаги и нейтрофилы. Продукция активных форм кислорода в этих клетках начинается при их активации. Функциональное предназначение такой продукции – инактивация фагоцитированных патогенов и последующее завершение фагоцитоза.
В качестве примера рассмотрим биохемилюминесценцию, наблюдаемую при активации нейтрофилов. Она связана с продукцией в этих клетках при активации супероксидного анион-радикала ( ).
).  продуцируется вследствие переноса электрона с НАДФ×Н2 на молекулярный кислород:
продуцируется вследствие переноса электрона с НАДФ×Н2 на молекулярный кислород:

Использованный НАДФ×Н2 затем регенерируется в ходе работы гексозомонофосфатного шунта. Образовавшийся  может опосредовать следующие реакции:
может опосредовать следующие реакции:
(1) 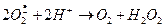
(2) 
(3) 
(4) 
(5) 
Реакция (4) в приведенной схеме катализируется специальным ферментом – миелопероксидазой, а реакция (1) резко ускоряется другим энзимом – супероксиддисмутазой (СОД, дисмутазой супероксидных анион-радикалов). Возможность протекания реакции (5) показана в модельных системах, но пока неясно, протекает ли она в нейтрофилах. Эта реакция интересна тем, что в ее ходе продуцируются возбужденные молекулы кислорода (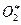 ). Напомним, что для этого элемента в невозбужденном состоянии нормальным является расположение электрона на триплетной электронной орбитали, которая в данном случае более выгодна энергетически. При возбуждении же один из электронов в молекуле кислорода переходит на синглетный уровень. Такое состояние молекул О2 принято называть синглетным кислородом (обозначается, как 1О2). Химическая активность у 1О2 значительно выше, чем у О2, поскольку он является молекулой с избытком свободной энергии.
). Напомним, что для этого элемента в невозбужденном состоянии нормальным является расположение электрона на триплетной электронной орбитали, которая в данном случае более выгодна энергетически. При возбуждении же один из электронов в молекуле кислорода переходит на синглетный уровень. Такое состояние молекул О2 принято называть синглетным кислородом (обозначается, как 1О2). Химическая активность у 1О2 значительно выше, чем у О2, поскольку он является молекулой с избытком свободной энергии.
Природа химических реакций в нейтрофилах, обуславливающих продукцию электронно-возбужденных продуктов и генерацию квантов биохемилюминесценции, до сих пор точно не установлена. Имеются только предположения, согласно которым биохемилюминесценция связана с окислением каких-то компонентов клеток перекисью водорода, гидроксильными радикалами ОН· или гипохлоритом ( ).
).
Максимум в спектре биохемилюминесценции у активированных нейтрофилов расположен около 570 нм. Поскольку ее интенсивность обычно мала, из-за чего это свечение трудно регистрировать, для усиления биохемилюминесценции фагоцитов применяются хемилюминесцентные индикаторы, в частности, люминол. В его присутствии интенсивность биохемилюминесценции возрастает в 10-100 раз, а максимум излучения смещается в область 370-500 нм (т.е. в область люминесценции перекисей люминола, см. выше).
Следует отметить, что способность фагоцитирующих клеток к биохемилюминесценции отражает функциональную активность этих клеток. Поэтому ее измерение (обычно в присутствии люминола) применяется в клинике для диагностики, например, скрытых воспалительных процессов в организме пациента или при выявлении нарушений в работе иммунной системы.
Дата добавления: 2015-07-25; просмотров: 357 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Замедленная флуоресценция и фосфоресценция. | | | Проточная цитофлуориметрия. |