
Читайте также:
|
Поскольку электронно-возбужденное состояние для молекул является термодинамически неустойчивым, возбужденные молекулы сильнее реагируют на изменения в окружении, чем невозбужденные. Наибольшее влияние на них оказывают такие показатели, как полярность близ расположенных молекул, их подвижность, диэлектрическая проницаемость среды.
Рассмотрим возможные сдвиги в характере фотолюминесценции при изменении диэлектрической проницаемости среды. Напомним, что относительная диэлектрическая проницаемость (будем здесь обозначать ее E) – физическая величина, показывающая, насколько сила взаимодействия двух единичных электрических зарядов в данной среде меньше, чем в вакууме. Относительная диэлектрическая проницаемость, по определению, величина безразмерная.
Каждая молекула в каждый конкретный момент времени является диполем (у которого «+» - суммарный заряд ядер, а «-» - суммарный заряд электронов). Как и любой другой диполь, молекула, таким образом, может быть охарактеризована величиной дипольного момента. Поскольку и ядра, и электроны в молекуле смещаются друг относительно друга из-за тепловых колебаний, величина дипольного момента молекулы во времени постоянно варьирует. Такие диполи принято называть осциллирующими. При электронном возбуждении среднее расстояние между электронами и ядрами в молекуле возрастает. Соответственно, значимо увеличивается и дипольный момент такой молекулы. Иными словами, возбужденная молекула – обычно более сильный диполь, чем невозбужденная. При пребывании в полярном растворителе такой диполь вызовет формирование вокруг себя слоя ориентированных соответствующим образом дипольных молекул растворителя. К чему это приводит, представлено на рис. 21.
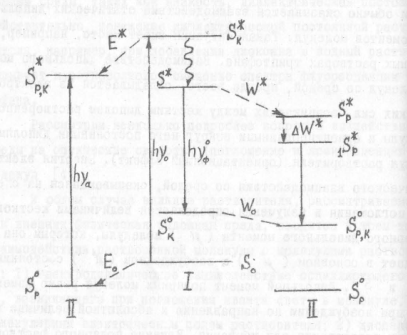
Рисунок 21. Сдвиги в электронных энергетических уровнях молекулы при ее перемещении из неполярного (I) в полярный (II) растворитель. Пояснения в тексте. Публикуется с модификациями по: Рощупкин Д.И., Потапенко А.Я., Клебанов Г.И. Практикум по биофизике. Часть 1. Лабораторные работы по спектральным методам исследования и фотобиологии. М.: 1975, с. 21.
При помещении молекулы-диполя в полярный растворитель происходит взаимодействие дипольных моментов самой молекулы и дипольных моментов окружающих ее молекул растворителя. Обозначим величину дипольного момента у рассматриваемой молекулы в основном состоянии m0, а в возбужденном - m*. Пусть m* будет больше m0. В ходе ориентации молекул растворителя и формирования вокруг растворенного молекул соединения сольватационных оболочек в этих молекулах происходит смещение вниз по величине энергии основного электронного уровня S0. Величина этого сдвига соответствует энергии сольватации Е0. Изменяется и энергия возбужденного уровня S*. Однако сдвиг здесь происходит на другую величину (m*>m0) - Е*. Из-за различия в величинах Е0 и Е* происходит смещение частоты максимума поглощения рассматриваемых молекул:
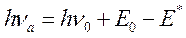
После преобразований получаем, что величина сдвига частоты максимума поглощения (Dn=hna-hn0) при перемещении молекулы из неполярного растворителя в полярный составит:
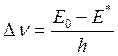
Поскольку мы постулировали, что m*>m0, в нашем случае Е* будет больше Е0. Соответственно, произойдет смещение максимума поглощения вещества в длинноволновую сторону.
При последующем испускании кванта фотолюминесценции излучательный переход происходит с нижнего из возможных колебательных подуровней молекулы люминофора (т.е. в неполярном растворителе квант будет испускаться при переходе S*® S0). Однако в полярном растворителе энергия уровня S* будет снижена на величину Е* и составит рS*. В синглетно-возбужденном состоянии молекула-люминофор пребывает 10-8¸10-9 секунды. Этого времени достаточно, для того, чтобы молекулы растворителя вокруг молекулы-люминофора успели переориентироваться. В результате энергия уровня рS* дополнительно падает на величину энергии сольватации DW*, и становится равной 1S*р. Заметим, что это произойдет только в том случае, если время переориентации молекул растворителя значимо меньше времени жизни синлетно-возбужденных молекул-люминофоров. При низких температурах (менее 170о К) это условие не выполняется, поэтому излучение кванта фотолюминесценции происходит с более энергонасыщенного уровня.
В обычных же условиях из-за более выраженного изменения энергии уровня S* в полярном растворителе максимум в спектре фотолюминесценции смещается значительно сильнее, чем в спектре поглощения.
После излучения кванта фотолюминесценции молекула люминофора стабилизируется не сразу. Изначально ранее возбужденный электрон попадает на высший колебательный подуровень S0р,к основного состояния. В ходе этого перехода дипольный момент молекулы снижается, однако переориентация молекул растворителя происходит позже. Соответственно, энергия сольватации в основном состоянии Wо оказывается меньше, чем энергия сольватации W* в возбужденном. Далее начинается процесс переориентации молекул растворителя, сопровождающийся дальнейшим падением Wо. В результате энергия уровня S0р,к нарастает, т.е. должно произойти дополнительное смещение спектра фотолюминесценции в длинноволновую сторону. В целом, величина смещения частоты максимума фотолюминесценции в полярном растворителе может быть описана следующей формулой:
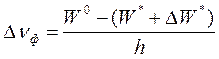
Измеряя величину смещения полос в спектрах поглощения и фотолюминесценции молекул растворителях различной полярности, можно определить, насколько меняется дипольный момент этих молекул при возбуждении. Квантовая теория ориентационных взаимодействий молекулярных диполей дает следующую формулу:
|
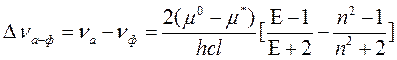
В уравнении (79) nа – частота излучения в максимуме поглощения вещества; nф – частота излучения в максимуме его фотолюминесценции; m о и m * - вектора дипольных моментов молекулы в основном и возбужденном состоянии, h - постоянная Планка; с - скорость света, l – радиус рассматриваемой молекулы-люминофора; E - относительная диэлектрическая проницаемость растворителя; n – его коэффициент преломления.
Расчет изменения дипольного момента вследствие электронного возбуждения по формуле (79) для триптофана дает величину Dm=m *- m о в 6 Дебай. Иными словами, полоса фотолюминесценции этого соединения смещается при изменении полярности окружения достаточно сильно. Поскольку во многих нативных белках остатки триптофана находятся в гидрофобных, относительно неполярных, частях молекул, вышеуказанное свойство позволяет применять измерение спектров фотолюминесценции триптофана (его остатков в полипептидной цепи изучаемого протеина) для исследования процесса денатурации белков.
Иногда в биологических образцах не удается зарегистрировать собственной фотолюминесценции содержащихся в них молекул-люминофоров. Причин этому может быть несколько, и мы рассмотрим некоторые из них ниже. Здесь же можно отметить, что в таких ситуациях в биологический объект специально вводят извне искусственные люминофорные молекулы, отличающиеся высоким квантовым выходом фотолюминесценции. Если введенный люминофор не присоединяется к какому-либо из компонентов объекта ковалентными связями, его принято обозначать, как флуоресцентный зонд. Если же люминофор ковалентно сшивается с молекулами образца, то это – флуоресцентная метка.
Как и у всех люминофоров, параметры фотолюминесценции у флуоресцентных зондов и меток меняются при изменении их окружения, что позволяет использовать данные соединения для изучения различных характеристик биологических объектов.
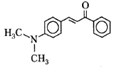
В качестве примера приведем значения спектрального положения максимума поглощения и фотолюминесценции для одного из флуоресцентных зондов, диметилхалкона (ДМХ, табл. 2).
Таблица 2. Спектральное положение максимумов поглощения и фотолюминесценции у флуоресцентного зонда диметилхалкона (ДМХ) в растворителях различной полярности.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 45.
Структурная формула ДМХ:
| |||
| Тип растворителя | Относительная диэлектрическая проницаемость растворителя E | Положение максимума поглощения, нм | Положение максимума фотолюминесценции, нм |
| Гептан | 1,9 | ||
| Толуол | 2,4 | ||
| Бутанол | 17,7 | ||
| Метанол | 32,7 | ||
| Вода |
Следует заметить, что, поскольку от окружения молекулы-люминофора зависит не только спектральное положение максимума фотолюминесценции, но и квантовый выход этого вторичного свечения, с помощью флуоресцентных зондов можно анализировать достаточно сложные биологические процессы. Например, у так называемых Са2+-чувствительных флуоресцентных зондов (quin-2, fura-2, fura-3) квантовый выход фотолюминесценции возрастает на 2-3 порядка после связывания с молекулой зонда иона Са2+. Это обстоятельство позволяет с помощью подобных зондов регистрировать, в частности, кинетики изменения концентрации Са2+ в цитоплазме клеток в процессе физиологической активации в режиме реального времени.
Дата добавления: 2015-07-25; просмотров: 151 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Время жизни возбужденного состояния молекул. Связь между временем жизни возбужденных состояний и квантовым выходом фотолюминесценции. | | | Причины снижения интенсивности фотолюминесценции в биологических объектах. Тушение фотолюминесценции. Миграция энергии электронного возбуждения. |