
Читайте также:
|
Способности кислорода и серы к формированию ХС. Аллотропия. Атомы любого галогена, а также Н, имея один неспаренный электрон, могут существовать лишь в виде одного простого соединения Э2. У атомов же халькогенов два неспаренных е и потому возможны варианты, например, в случае кислорода:
1) или данный атом O образует двойную связь со вторым О, формируя молекулу простого вещества 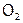 (его, как и сам элемент, называют кислородом):
(его, как и сам элемент, называют кислородом): 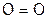 ;
;
2) или О дает две связи с двумя атомами O; при этом получается молекула другого простого соединения кислорода – озона 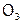 .
.
Наличие у элемента нескольких простых веществ, различающихся числом атомов в молекуле или структурой решетки, называют аллотропией. Так что О2 и О3 – это аллотропные формы кислорода.
Отметим, что в случае озона ст.ок. центрального атома кислорода считается равной +4, а, следовательно, у концевых – по –2.
В случае серы формирование простых соединений происходит иначе, чем у кислорода, а именно: образуются многоатомные цепи и циклы.
осями связей) замыкаются в циклы 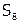 .
.
Простые вещества серы. Различают несколько аллотропных форм S: ромбическую, моноклинную, пластическую и др. Причем 1-ая и 2-ая построены из одинаковых циклических молекул S8, но ориентированы эти частицы относительно друг друга по - разному, что и обеспечивает разную форму кристаллов, а также немного отличающийся их цвет.
Причем при об.у. устойчива ромбическая сера – кристаллы в виде ромбов ярко желтого цвета. А при нагревании выше 96°С ориентация молекул S8 изменяется и образуются более светлые кристаллы в виде длинных призм – это моноклинная сера. При 119°С она переходит в легкоподвижную желтую жидкость, которая выше 160°С начинает темнеть и густеть, т.к. происходит разрыв циклов S8 и образование длинных цепей Sn , где n может достигать нескольких сотен тысяч (при 200-2500С).
Напомним, чем более многоатомны частицы, тем больше число контактов для осуществления дисперсионных взаимодействий между ними. Вот почему расплав серы при нагревании (в интервале 160 ОС – 250 ОС, но не выше) густеет.
Если такой расплав резко охладить (например, вылив в холодную воду), то цепи Sn сохраняются и получается тягучая масса коричневого цвета – пластическая сера. Она имеет волокнистую структуру решетки, а не молекулярную, как ромбическая или моноклинная S.
Физические свойства. Вследствие многоатомности цепейпластическая сера не растворяется в органических жидкостях, в отличие от ромбической и моноклинной. В воде же все аллотропные формы S практически нерастворимы.
Кислород, хотя и ограничено, но растворяется в воде (30 мл/л при об.у.), что обеспечивает дыхание рыб и других водных животных[13]. (В Мировом океане находится 1013 т 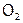 .) Растворимость озона в воде в 9 раз выше, чем О2 (благодаря полярности частиц О3). Имея к тому же больше атомов в молекуле и как следствие большую молекулярную массу, озон и кипит выше (при -112 °С).
.) Растворимость озона в воде в 9 раз выше, чем О2 (благодаря полярности частиц О3). Имея к тому же больше атомов в молекуле и как следствие большую молекулярную массу, озон и кипит выше (при -112 °С).
Дата добавления: 2015-07-25; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика. Нахождение в природе. Получение | | | Химические свойства и применение простых веществ |