
Читайте также:
|
При образовании соединений из атомов химические связи могут формироваться не только спариванием неспаренных электронов, т.е. по обменному механизму, но и по донорно - акцепторному механизму.
Например, в молекуле  . Она получается из 1 атома железа и 5 молекул СО. Ее графическая формула:
. Она получается из 1 атома железа и 5 молекул СО. Ее графическая формула:
 |
Любая валентная орбиталь элемента способна участвовать в образовании ХС. А именно: если она свободна, то может акцептировать пару е от атома, с которым формирует ХС; если содержит 2 е, то способна давать их на свободную орбиталь другого атома; а если имеет неспаренный электрон, то связь может образоваться по обменному механизму. Вот почему значение ПВ определяется числом всех валентных орбиталей.
Однако, ПВ атомов в соединениях может использоваться не полностью, а лишь частично. Такая проявленная валентность элемента (обозначим ее буквой В), т.е. практически реализованная в данном конкретном веществе, является одной из характеристик элемента в составе соединения.
Значение В ориентировочно определяют как сумму кратностей всех ХС, образованных данным атомом в данном соединении. Очевидно, величина В не может быть больше значения ПВ, а лишь равной ПВ или (чаще) меньше его.
Отметим, что иногда одна орбиталь участвует в образовании двух ХС, и в этом случае кратность каждой из таких связей считается равной 0,5. Например, возьмем молекулу H2F2. Ее графическая формула:
H – F - - Н - - F.
Здесь водород на левом конце молекулы связан с атомом фтора ординарной связью, т.е. кратность ХС равна единице и, значит, В(Н)=1. В случае центрального атома водорода единственная его валентная орбиталь образует две химические связи с двумя атомами F, и кратность каждой из этих ХС равна 0,5 (поэтому они изображены пунктиром), а В(Н)=0,5+0,5=1. Таким образом, оба атома водорода в H2F2 одновалентны, хотя образуют разное число ХС.
К характеристикам элемента в составе вещества (кроме числа сформированных ХС, их кратности и значения В) относятся также следующие величины:
- координационное число (к.ч.), т.е. число атомов, с которыми элемент образует ХС;
- степень окисления (ст.ок.) элемента;
- эффективный (реальный) заряд элемента (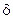 );
);
 |
Здесь кратность каждой связи равна 1,5, значит, В=3, в то время, как к.ч. азота в данной молекуле составляет 2, а число химических связей, которые N образует с атомами O, равно четырем. (В структурной формуле NO2 две из ХС (одинарные) изображены сплошной чертой, а две другие (с кратностью 0,5) – пунктирной.)
Характеристики атома азота в составе разных частиц (ПВ=4) Таблица 2
| Частица | ЧХС* | В | к.ч. | ст.ок. | Знак 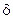
|
| |||||

| –3 | – | |||

| +4 | + |
*Число химических связей.
1.3. Нахождение в природе. Способы получения
простых веществ
В природе, как правило, элементы образуют наиболее стабильные формы, т.е. находятся в устойчивых ст.ок. и соединены с теми элементами, которые обеспечивают данную устойчивость.
При этом вещества, имеющие достаточно ионные связи, чтобы являться растворимыми, накапливаются, в основном, в гидросфере (реки, моря, океаны и т.п.). Напротив, соединения с преимущественно ковалентной связью и прочной кристаллической решеткой составляют большую часть литосферы [1] (земной коры), летучие же вещества присутствуют в атмосфере.
Если элемент образует стабильное простое соединение, то оно, как правило, встречается и в природе. В таком случае промышленные способы его получения – это очистка данного вещества от примесей или выделение его из смеси. Часто такие операции осуществляют с помощью физических методов. Например, при получении  и
и 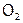 применяют ректификацию воздуха.
применяют ректификацию воздуха.
Если же природное соединение целевого элемента – сложное соединение, то, в зависимости от знака ст.ок. элемента, его простое вещество получают или окислением (при отрицательной ст.ок. элемента) или восстановлением (если ст.ок. элемента положительна).
При этом в промышленности стараются использовать достаточно дешевые реагенты. Так, для восстановления металлов (например, железа) из оксидных руд (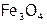 ) чаще берут уголь (кокс).
) чаще берут уголь (кокс).
Не оксидные руды обычно предварительно переводят в оксиды. С этой целью карбонаты разлагают нагреванием, а сульфиды «обжигают», т.е. прокаливают в присутствии кислорода, обычно О2 воздуха. (При этом, например, NiS переходит в NiO.)
Многие простые вещества получают электролизом раствора или расплава соответствующих сложных соединений. (При этом, напоминаем, катод является восстановителем, а анод – окислителем.) Например, электролизом расплава  выделяют
выделяют 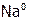 (на катоде) и
(на катоде) и 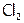 (на аноде).
(на аноде).
Дата добавления: 2015-07-25; просмотров: 72 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Характеристики изолированных атомов | | | Сходство с галогенами |