
Читайте также:
|
Оксиды. Кислород в оксидах металлов и неметаллов, находясь в ст.ок. (–2), проявляет валентные состояния от 2 до 4, а значения к.ч. от 1 до 8. С элементами своей подгруппы[43] он образует устойчивые соединения состава ХO2 и ХO. 3 Получены также оксиды: S O8 (где атом O соединен с циклом S; 8 выше 200C S O8 разлагается на S и SO2 ), S2O (который является по сути оксид-сульфидом S(IV)) и др.
Оксиды ХO2 можно синтезировать из ИПВ, но сернистый газ дешевле получать обжигом пирита (см. выше). Соединения ХO 3 образуются при окислении диоксидов, причем SO2 взаимодействует даже с кислородом воздуха, но лишь в присутствии катализатора (например, V2O5 )[44]. Этот процесс осуществляется в производстве серной кислоты.
Оксиды остальных халькогенов в ст.ок. (+6), как менее устойчивые, дешевле получать не окислением ХO2 (для чего требуются жесткие условия), а реакцией замещения:
K 2SeO4 + SO3 → K 2SO4 + SeO3 [45]
или дегидратацией:
H6 TeO6 ⎯⎯−H2⎯O → TeO3 [46].
t
В молекулах SO2 и SO (3 когда эти оксиды находятся в газообразном состоянии) имеет место sp -2 гибридизация орбиталей атомов серы. Но если диоксид серы и при об.у. остается газом (т.кип. = −100 С), то триоксид сжижается ниже 44,80C.
Указанное различие объясняется не только большей атомностью молекул SO (?), 3 но и большим стремлением S(VI) к четырехкратной координации, поскольку отсутствие у них НЭП (в отличие от S(IV)) обеспечивает более устойчивую связь S(VI) с кислородом. Это способствует обобществлению атомов O соседними молекулами триоксида серы, вызывая полимеризацию последнего[47].
Обобществление O осуществляется за счет неучаствующей в σ-перекрывании р-орбитали S(VI) и НЭП кислорода соседней молекулы (на s-орбитали). При этом sp –2 гибридизация переходит в sp, 3 стабилизированную π(р-d)-перекрыванием d-орбиталей серы и НЭП кислорода (р-орбитали).
Диоксид серы, не проявляя склонности к полимеризации, тем не менее за счет наличия свободной р-орбитали и стремления атомов серы к sp -3 гибридизации
(стабилизированной π(р-d)-перекрыванием) склонен при об.у. к реакциям присоединения (воды, оксидов металлов и т.п.). С пигментами диоксид образует бесцветные соединения по ассоциативному механизму, что используется для мягкого отбеливания (шерсти, шелка, бумаги)[48].
При переходе от серы к полонию повышается способность атомов халькогенов к более высокой координации (см. табл. 6) за счет роста их валентности [3] и атомного радиуса. К тому же, из-за увеличения радиуса Х уменьшается отталкивающее действие НЭП, а также растут эффективные заряды на атомах Х и O (как результат повышения разности Э.О.). Свой вклад оказывает и снижение интенсивности теплового движения молекул с ростом молярной массы оксида. Все это приводит к тому, что (в отличие от SO2 ) SeO2 полимеризуется в цепи, а TeO2 и PoO2 даже организуют координационные кристаллические решетки и, как следствие, являются при об.у. твердыми веществами.
Таблица 6. Характеристика оксидов ХO2
| Оксид | Тип Гибридизации | Значение координационных чисел в оксидах | |
| к.ч.(Х) | К.ч.(О) | ||
| SO2 SeO2 TeO2 PoO2 | sp 2 sp 3 sp3d2 sp3d3f | 1 и 2 |
В твердом состоянии при об.у. находятся и их оксиды в ст.ок. (+6), причем, они, как и SO, 3 могут существовать в стекловидной и асбестовидной формах.
Гидроксиды. Кислоты халькогенистые (H2 ХO3 ) и халькогеновые (H2 ХO4 ), кроме гидроксидов теллура, получают действием воды на соответствующие оксиды.
При растворении SO2 в воде (предел: 40 V в 1 V при об.у.) образуются, в основном, клатраты SO2 ⋅ 7,67H2O [49] и гораздо в меньшем количестве молекулы H2SO3 . Последние находятся в двух таутомерных формах (таутомерия – это обратимая изомерия). А именно, есть форма:
HO 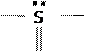 OH
OH
O
которая за счет наличия НЭП (указана в формуле точками у атома S), способной образовывать связь с протоном, и вследствие стремления серы к четырехкратной координации, сосуществует с формой:
H
O  OH
OH
O
Напротив, в молекуле серной кислоты атом S координационно насыщен, все его валентные электроны являются связывающими, так что таутомерии быть не может. И сама кислота гораздо устойчивее сернистой (?): выделена в свободном состоянии; а начинает разлагаться (на H2O и SO) 3 лишь при т.кип.=279,60С [50]. За счет такой устойчивости серной кислоты оксид серы(VI) при растворении в воде полностью переходит в молекулы (и ионы) этой кислоты вплоть до 100%-ной H2SO4 . Более того, последняя тоже способна растворять серный ангидрид до 65% (мас.) с образованием олеума (смесь поликислот: H2SO4 ⋅nSO3 , где n=2÷4).
Процесс формирования поликислот сопровождаются небольшим выделением тепла, поэтому в производстве серной кислоты сначала получают олеум, который потом разводят водой до 98%-й H2SO4, А непосредственное взаимодействие SO 3 с H2O из-за очень значительного экзоэффекта приводит к образованию плохо конденсируемого сернокислотного тумана.
Отметим, что не только SO, 3 но и H2SO4 с большим экзоэффектом (жадно) поглощает воду, образуя достаточно прочные гидраты состава: H2SO4 ⋅ nH2O (n=1÷6), поэтому применяется как осушающее средство.
Селеновая кислота тоже образует гидраты (n=1,2,4). В отличие от серной кислоты, жидкой при об.у., селеновая является твердой (т.пл.=630С) за счет большей координирующей способности селена (?). По той же причине селенистая кислота устойчивее сернистой (дегидратирует лишь при 700С), поэтому выделена в свободном состоянии (в виде твердого вещества, растворимого в воде).
В то же время теллуристая кислота малорастворима за счет стремления Te к шестикратной (?) координации (и, как результат, к большей степени обобществления атомов O). Получают ее из оксида по реакциям:
TeO2 + NaOH → Na2 TeO3 + H2O,
Na2 TeO3 + HCl → TeO2 ⋅nH2O + NaCl.
Приведенная формула теллуристой кислоты отражает переменность ее состава вследствие дегидратации, протекание которой (уже с момента ее образования) объясняется следующим. В мономере H2 TeO3 атом Te координационно ненасыщен, поэтому идет процесс оляции, т.е. образование оловых мостиков (гидроксомостиков) за счет обобществления ОН-групп соседними молекулами мономера [3]:
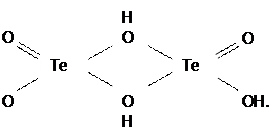
Эти мостики из-за сильного поляризующего действия двух атомов Te(IV) дегидратируются (отщепляют молекулы H2O) и переходят в оксомостики (процесс оксоляции):
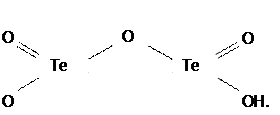
Однако в результате оксоляции к.ч. теллура уменьшается! Что обусловливает процесс оляции с другими соседними молекулами, и т.д. В итоге происходит полимеризация продукта, сопровождающаяся его дегидратацией, и как следствие, снижение его растворимости.
В молекуле ортотеллуровой кислоты H6 TeO6 атом Te координационно насыщен, поэтому подобные процессы не протекают и кислота растворима. Синтезируют ее, как и теллуристую кислоту, тоже в 2 стадии:
Na2 Te + NaNO3 ⎯⎯сплав⎯⎯. →Na2 TeO4 + NaNO2 ,
Na2 TeO4 + HNO3 ⎯⎯ →р−⎯р H6 TeO6 + NaNO3 .
Нагреванием кристаллов ортотеллуровой кислоты выше температуры плавления (1360С) можно получить метакислоту H2 TeO4 (сиропообразная жидкость при об.у.).
Отметим, что окислением кислородосодержащих соединений с ц.а. в высшей ст.ок.
можно синтезировать т.н. надкислоты, содержащие пероксогруппы O2−2 (т.е. −O−O−) вместо оксочастиц O−2 . В частности получены двунадсерная кислота (т.пл.=650C):

и мононадсерная (т.пл.=470С):
H 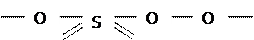 H
H
O O
Они являются сильными кислотами (но вторая константа диссоциации у H2SO5 очень мала - 10−[51]0 ); легко гидролизуются (с образованием H2O2 и H2SO4 ). Их устойчивость к восстановителям снижается в ряду: H2O2 > H2S2O8 > H2SO5 , т.к. прочность мостика (− O − O −) тем меньше, чем больше электрофильность 1 радикалов на его концах и чем выше асимметрия электронной плотности связи O − O.
О диссоциации кислот. Зависимость значений констант диссоциации кислот от природы Х и значения его ст.ок. та же, что и в случае галогенов. В частности, селеновая кислота по силе почти равна серной (n(O[52]−) /n(OH−) = 1 и K1 = 1⋅103 ), а при переходе к теллуровой кислоте (имеющей n(O2−) /n(OH−) = 0) наблюдается резкое снижение значения K1 (до 2 ⋅10−8 ) (?). Хотя получены нормальные (некислые) соли ортотеллураты:
Ag6 TeO6 , Hg3 TeO6 и др.
Окислительно-восстановительные свойства. В соответствии со значениями
E0 (Х 6+ / Х 4+) 2 восстановительные свойства соединений селена и теллура в ст.ок. (+4)
из-за эффекта d-сжатия (?) слабы – проявляются лишь при действии сильных окислителей (Cl2 или K 2Cr2O7 в кислой среде). Напротив, соединения серы(VI) особенно устойчивы и, как следствие:
1). Сера(IV) легко окисляется O2 воздуха:
H2SO3 + O2 → H2SO4 ,
и даже серой:
Na2SO3 + S ⎯⎯→t Na2S2O3
Продукт - тиосульфат – представляет собой сульфат, в котором одна оксочастица O−2 замещена на тиочастицу S−2 .
Кроме того, S(IV) окисляется своими аналогами, находящимися в ст.ок. (+4):
SO2 + ХO2 = Х + SO3 .
Эта реакция используется при получении Se и Te из отходов производства.
2). Для соединений серы(IV), в отличие от селена(IV) и теллура(IV), характерна дисмутация:
SO2 + NaOH → Na2SO3 → Na2SO4 + Na2S;
3). Соединения серы(VI) – наиболее слабые окислители из соединений халькогенов. (Сравним: E0 (SeO24− /H2SeO3 ) = 1,15 В, а E0 (SO24− /H2SO3 ) = 0,17 В.) Так, в отличие от серной кислоты, концентрированная теллуровая и даже разбавленная селеновая окисляют хлорид-ионы; кроме того, H2SeO4 в кислой среде переводит Mn 2+ в MnO; 4− а SeO 3 взрывается при контакте с органическими веществами; возможна и реакция:
Au + H2SeO4 (конц.) ⎯⎯200⎯0⎯C → Au2 (SeO4 )3 + H2SeO3 + H2O.
В то же время концентрированная серная кислота не действует на золото, а также на железо (вследствие его пассивации плотной оксидной пленкой), хотя растворяет большинство металлов (Ag при нагревании до 1600С). Причем, чем активнее металл, тем полнее он восстанавливает серу(VI): Ag 0 в основном до SO2 , а Ca – 0 до H2S (в качестве продукта восстановления может быть и S). 0
4). В отличие от селенатов и теллуратов щелочных металлов, термически неустойчивых:
Na2SeO4 ⎯⎯→t Na2SeO3 + O2 ,
сульфаты ЩМ даже кипят без разложения. Однако соли многозарядных металлов разлагаются на оксиды при нагревании:
<6000 C
⎯⎯⎯0⎯→MmOn + nSO3
Mm (SO4)n >600 C
⎯⎯⎯⎯→MmOn + nSO2 + n / 2 O2.
Отметим, что дегидратацией NaHSO 3 получают дисульфит (Na2S2O5 [53]), а нагреванием гидросульфата щелочного металла – дисульфат (Na2S2O7 ). При большем нагревании подобных солей их димерные (и более полимерные) анионы переходят в мономерные (за счет летучести соответствующих оксидов), как например, трисульфат:
Na2S3O10 = Na2SO4 + 2SO3↑.
Политиосоединения. Политионовые кислоты, имеющие общую формулу: H2SnO6 , где n=2÷6, представляют собой два сульфатных радикала HSO, 3 соединенных друг с другом или непосредственно центральными атомами серы (n=2) или через атом S, или через гомоядерную цепь серы (n>2). Например, тетратионовая кислота графически изображается следующим образом:
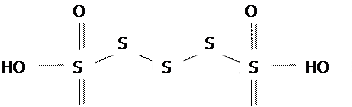
O O
Они относятся к сильным кислотам (?), но легко разлагаются с образованием H2SO4 и S (или SO2 в случае дитионовой кислоты). Их соли более устойчивы (?), выделены в свободном состоянии и используются в качестве восстановителей. Получают, например, дитионаты мягким окислением соединений S(IV):
H2SO3 + MnO2 → MnS2O6 + H2O.
Напротив, мягким восстановлением серы(IV) синтезируют, в частности, дитионистую кислоту:
H2SO3 + H2S → H2S2O4 ,
или ее соль:
SO2 + Zn → ZnS2O4 .
Обрабатывая дитионит цинка содой, получают Na2S2O4 . Его водный раствор столь активно проявляет восстановительные свойства, что используется для поглощения кислорода:
Na2S2O4 + H2O + O2 → NaHSO3 .
Даже в отсутствии O2 дитионит натрия неустойчив: медленно дисмутирует с образованием дисульфита и тиосульфата.
Дата добавления: 2015-07-25; просмотров: 117 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Перхалькогениды | | | Галиды и оксид-галиды |