
|
Читайте также: |
Общая характеристика. В отличие от фтора, его аналоги в соединениях с кислородом имеют положительный эффективный заряд (δ). Однако в силу высокой доли ковалентности связей, он невелик. Так, если в достаточно ионном веществе Na2O δкислорода=–0,81, то в Cl2O7 всего –0,01.
В табл. 2 приведены некоторые из описанных в учебной литературе соединений (вещества, формулы которых помещены в квадратные скобки, крайне неустойчивы).
Отметим, что молекулы оксидов галогенов в четной ст.ок. являются по существу радикалами, которые под действием воды (см. табл.2) или при димеризации образуют вещества, содержащие атомы галогенов в нечетных ст.ок., например:
ClO3 → Cl2O6, т.е. O2Cl+5 − O − Cl+7O3 .
В димерах оксидов хлора атомы галогена соединены через кислород, хотя в литературе есть сведения, что, в частности, BrO2 димеризуется за счет образования связи
Br − Br.
Устойчивость соединений хлора. Кислородосодержащие соединения хлора – типичные окислители (E0 >> 0). Причем в соответствии с формулой Нернста [3] значение их Е растет (а значит, устойчивость падает) с повышением концентрации раствора и кислотности среды. Посладнее характерно для всех кислородосодержащих веществ и объясняется связыванием кислорода ионами водорода в молекулы воды:
H+
+ N
R = O + 2H + 2e → R = O + 2e → R + H2O.), O
H+
Очевидно, с ростом кислотности равновесие данного процесса смещается вправо, т.е. повышается окисляющая способность соединений подобного рода.
Подчеркнем, что особенно неустойчивы оксиды хлора. Так, Cl2O со взрывом разлагается на простые вещества при незначительном инициировании реакции, ClO2 и
ClO 3 взрываются, например, при контакте с органическими веществами, а Cl2O7
(наиболее устойчивый) – от удара. На практике используется относительно стабильный (но достаточно активный) ClO2 (как отбеливатель бумажной массы).
В случае гидроксидов при повышении ст. ок. хлора устойчивость тоже растет (а значит, окислительная активность падает). Например, хлорноватистая кислота (при об.у.) стабильна лишь в водном растворе с концентрацией не выше 20% (мас.), хлорноватая - не более 40%[22], а хлорная кислота выделена в свободном состоянии[23].
Рост стабильности объясняется упрочнением связей в анионах за счет уменьшения числа НЭП у хлора, а также увеличением отношения числа πперекрываний к количеству σ-связей от 0/1 в ClO− до 3/4 в ClO. 4− Сравните графические формулы кислот:
O O

 H O Cl, H O Cl O, H
H O Cl, H O Cl O, H  O, H
O, H 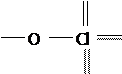 O.
O.
O
Кроме того, от НСlO к HClO4 растет симметрия аниона (как за счет увеличения числа атомов кислорода, так и в результате снижения поляризующего действия водорода из-за ослабления его связи с анионом - см. ниже раздел «Кислотные свойства гидроксидов»). А также снижается угол атаки атома хлора (т.е. его пространственная доступность для взаимодействия).
Соли кислот хлора, как более устойчивые (чем кислоты) соединения (?), все выделены в свободном состоянии, но и их активность увеличивается с понижением ст.ок. Cl. Так, KClO (3 бертолетова соль) окисляет иодид-ионы лишь в кислой среде, а KClO - и в нейтральной.
Однако с повышением температуры связи ослабевают и, как следствие, окислительно-восстановительная способность веществ растет, поэтому при сплавлении бертолетова соль окисляет иодид-ионы даже в щелочной среде.
При сравнительно небольшом нагревании тоже проявляется возрастание устойчивости соединений (и кислот, и солей) с повышением ст.ок. Cl, что иллюстрируют схемы реакций дисмутации:
ClO− ⎯⎯→t Cl− + ClO3−,
ClO3− ⎯⎯→⎯>t Cl− + ClO4− .
Первая стадия данных процессов – это отщепление атомарного кислорода, который при второй стадии окисляет исходный анион. Поэтому в присутствии диоксида марганца (катализатора первой стадии) продуктами термического разложения солей (а также кислот) являются, в основном, кислород и хлориды (в случае кислот – HCl). При нагревании хлората калия эти продукты образуются и без катализатора:
KClO3 ⎯⎯→t KCl + O2 .
Поэтому KClO 3 используется для получения O2 в лаборатории; а также в качестве компонента пороха, спичек, зажигательных смесей (при организации фейерверках и др.), ибо промежуточный продукт разложения хлората калия - атомарный кислород (“O”) - гораздо более сильный окислитель, чем O2 .
Гипохлориты (например, т.н. хлорная или белильная известь CaCl(OCl)) применяются для отбеливания х/б ткани, поскольку они под действием H2O и CO2 воздуха образуют хлорноватистую кислоту, способную при об.у. отщеплять “O”, разрушающий окрашивающие пигменты.
Перхлорат аммония используется в качестве ракетного топлива, т.к. содержит достаточно сильные и окислитель (ClO), 4− и восстановитель (NH); 4+ выше 900С взрывается, причем с образованием большого количества газов (N2 , НCl, O2 и H2O).
Таблица 2. Кислородосодержащие соединения галогенов

Зависимость устойчивости соединений от природы галогенов. Вторичная периодичность. Устойчивость кислородосодержащих веществ брома и иода растет с увеличением ст.ок. от (+1) до (+5) (как и в случае хлора), причем соединения I(V)
1 Пропуски для соединений Br и I заполните самостоятельно. 2 Формула молекул иодноватой кислоты: (HIO3)n, где n=2÷3.
наименее реакционноспособны среди всех кислородосодержащих веществ Г (не взрывоопасны в свободном состоянии при об.у.).
Однако при повышении ст.ок. Г до (+7) устойчивость соединений I и особенно Br падает (в отличие от хлора), что можно объяснить эффектом d-сжатия. Само d - сжатие это допольнительное уменьшение радиуса атомов в периодах (начиная с 4го) при движении слева направо вследствие роста Z ядра при заполнении электронами d-подуровней.
А эффект d-сжатия состоит в том, что при переходе от Cl к Br и от Br к I (за счет заполнения электронами предвнешних 3d и 4d-подуровней соответственно) происходит непропорционально большой прирост заряда ядра (Z∆) по сравнению с приростом орбитального радиуса атома (r∆). Причем, наиболее резко возрастает отношение ∆Z / r∆ при переходе от Cl к Br. Сравним: от F к Cl ∆Z / ∆r = 8 / 0,038 = 210, от Cl к Br ∆Z / ∆r = 18 / 0,009 = 2000, от Br к I ∆Z / ∆r = 18 / 0,017 = 1060 [24].
Как следствие эффекта d-сжатия, связь валентных электронов с ядром усиливается, при этом особенно значительно снижается энергия s-электронов, как наиболее проникающих к ядру[25]. А значит, вовлечение их в образование химической связи (что происходит при повышении ст.ок. брома и иода от (+5) до (+7)), оказывается очень затруднительным. Как результат, напротив, окислительная способность соединений I(VII), и тем более Br(VII), значительно выше, чем Сl(VII) – см. табл. 2 и 3.
Таблица 3. Значения E0 (Г+7 /Г+5 ) в кислой среде
| Г | Cl | Br | I |
| E0, B | 1,2 | 1,8 | 1,6 |
Уменьшение окислительной способности от Br(VII) к I(VII) объясняется не только ростом r и большим эффектом ЭЯНЭУ, но и увеличением значения координационного числа (к.ч.) с 4 (HBrO4 ) до 6 (H5IO6 ) (за счет большего r и больших валентных возможностей иода [3]).
Поскольку при переходе от Cl к Br отношение ∆Z / ∆r растет наиболее резко, то влияние d-сжатия сказывается на участии в образовании химических связей даже р-электронов. Поэтому все оксиды Br крайне неустойчивы, а соединения Br(V) являются более сильными окислителями, чем содержащие и I(V), и Cl(V) – см. табл. 2. Как следствие, термодинамически обусловлено протекание не только реакций:
HГO3 + I2 → HIO3 + Г2 , где Г = Cl или Br,
но и
HBrO3 + Cl2 → HClO3 + Br2 .
Кроме того, окислительная способность галогеноватистых кислот снижается при переходе от Cl к Br заметно меньше, чем от Br к I (сравните значения E 0 в табл. 2).
Подчеркнем, что хотя как окислитель HIO слабее, чем HClO (табл. 2), но как восстановитель – значительно сильнее, что обеспечивает меньшую устойчивость HIO.
Поэтому при дисмутации I2 в воде образуется, в основном, не она, а HIO. 3
Отметим, что подобно d-сжатию, при переходе от IА группы к IIA наблюдается s сжатие атомов, а от IIIA к VIIА - p- сжатие. Как результат эффекта этих сжатий, орбитальный радиус фтора (0,036нм) значительно меньше, чем водорода (0,053 нм), несмотря на большее число электронных уровней в атоме фтора.
А поскольку еще и заряд ядра фтора в 9 раз больше, чем у водорода, то понятно, почему валентный электрон последнего удерживаются гораздо слабее. Как следствие, соединения Н с положительной его поляризацией устойчивы настолько, что находятся в природе, а для F даже искусственно пока не получены.
Кроме того, при переходе от р-элементов 5-го периода к 6-му (в частности, от I к At) наблюдается эффект не только d-, но и f-сжатия, ибо при заполнении предпредвнешнего 4f-подуровня Z ядра увеличивается дополнительно на 14 единиц (в целом ∆Z = 32). Поэтому все р-элементы 6-го периода крайне нестойки в высшей ст.ок., образуемой за счет 6s-электронов[26]. Этого же можно ожидать и для At(VII).
Таким образом, устойчивость Г (а также многих p-элементов других подгрупп - см. ниже) в положительной ст.ок., особенно в высшей, уменьшается при переходе к четным периодам: ко 2-му (эффект s- и р-сжатий), к 4-му (из-за дополнительного d-сжатия) и 6-му (вследствие еще и f-сжатия). А при переходе к нечетным периодам – растет (?), т.е. проявляется т.н. вторичная периодичность 2.
 Кислотные свойства гидроксидов галогенов. Кислотно-оснóвные свойства любого гидроксида зависят от соотношения прочностей связей H − O и O − Э во фрагменте H − O − Э. Очевидно, чем больше электроотрицательность элемента, тем в большей степени электронная плотность от связи H − O смещена на связь O − Э (H − O − Э) и тем более кислотные свойства проявляет гидроксид.
Кислотные свойства гидроксидов галогенов. Кислотно-оснóвные свойства любого гидроксида зависят от соотношения прочностей связей H − O и O − Э во фрагменте H − O − Э. Очевидно, чем больше электроотрицательность элемента, тем в большей степени электронная плотность от связи H − O смещена на связь O − Э (H − O − Э) и тем более кислотные свойства проявляет гидроксид.
Поэтому важным фактором является природа галогена. Так, при переходе от хлора к иоду в соответствие с уменьшением значения Э.О. кислотные свойства гидроксидов снижаются (табл. 2). Причем настолько, что иодноватистая кислота диссоциирует по кислотному типу (K d = 4 ⋅10−1[27] ) в меньшей степени, чем по основному:
IOH → I+ + OH− (K d = 3 ⋅10−10 ).
Возможна даже реакция нейтрализации (но обратимая):
IOH + HNO3 → INO3 + H2O.
Однако, электроотрицательность определяется не только положением элемента в таблице Менделеева, но и значением его ст.ок.3, а также природой лигандов (L) в его окружении. В частности, связь Э с оксо-L сообщает ему большую электроотрицательность, чем связь с гидроксид-ионом, что видно из сравнения следующих данных:
Э ⇒ O (δ(О) ≈ −1), а Э → O ← H (δ(ОH) ≈ 0).
Как следствие, фактором, в наибольшей степени определяющим силу кислот, является соотношение числа оксо- n(O ) и гидроксо- n(OH) лигандов в анионе.
Например, сила кислот хлора (табл. 2) резко увеличивается с повышением его ст.ок. от (+1) до (+7), потому что (nO ) /(nOH) при этом значительно возрастает (от 0/1 до 3/1). С другой стороны, при переходе от HIO 3 к H5IO6 , хотя ст.ок. иода растет, но кислотные свойства снижаются[28], поскольку (nO ) /(nOH) уменьшается от 2/1 до 1/5.
Получение соединений. Из ИПВ можно в принципе синтезировать лишь один оксид – I2O5 , являющийся экзотермическим веществом. Остальные оксиды – эндосоединения, поэтому получают их косвенным путем, например, с помощью ОВР:
Cl2 + HgO → Cl2O + Hg2OCl2 ,
KClO3 + H2C2O4 → ClO2 + K2CO3 + CO2 + H2O.
А такой способ, как дегидратация гидроксидов применим лишь при синтезе четырех оксидов галогенов: Cl2O, Cl2O7 , I2O5 , I2O7 , относящихся к истинным ангидридам соответствующих кислот.
Гидроксиды галогенов (и их соли) синтезируют действием воды (или щелочи) на оксиды или реакциями дисмутации (см. выше), а также осуществлением других редокспроцессов, например:
Br2 + Cl2 + H2O → HBrO3 + HCl,
KIO3 + Cl2 + KOH → K5IO6 + KCl + H2O.
Кроме того, электролизом раствора хлорида натрия при определенном напряжении на аноде (и определенном материале анода) можно получить не Cl2 , а ClO − или ClO, 3− или ClO. 4− Анодным окислением щелочного раствора бромата натрия в 1968 г. впервые синтезировано соединение брома(VII). Примерно в это же время впервые была осуществлена и другая реакция переведения брома в:ст. ок. (+7):
NaBrO3 + F2 + NaOH → NaBrO4 + NaF + H2O.
Для синтеза кислот и их солей используют также обменные процессы:
Ba(IO3)2 + H2SO4 → HIO3 +↓BaSO4 , Ca(ClO3)2 + KCl→↓KClO3 + CaCl2 .
Соли получают и действием соответствующих кислот на оксиды или гидроксиды М.
Дата добавления: 2015-07-25; просмотров: 99 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Галогениды водорода | | | Галиды галогенов |