
|
Читайте также: |
Строго отделить химическую коррозию от электрохимической трудно, а иногда и невозможно. Дело в том, что электрохимическая коррозия часто связана с наличием в металле случайных примесей или специально введенных легирующих добавок.
Наличие растворенного в жидкости кислорода приводит к усилению процесса коррозии. Присутствие в жидких неэлектролитах влаги обеспечивает интенсивное протекание процесса коррозии по электрохимическому механизму.
Например, при содержании в тетрахлориде углерода следов воды, скорость коррозии стали резко возрастает:
CCI4 + H2O  CCI3OH + HCI;
CCI3OH + HCI;
CCI4 + H2O  СO + 4HCI;
СO + 4HCI;
что связано с образованием агрессивных продуктов (электролитов) при гидролизе. Алюминий разрушают даже безводные хлорсодержащие органические растворители.
Сущность первой электрохимической теории состояла в том, что примеси в металлах создают микрогальванические элементы, в которых происходит перетекание электронов от анодных участков к катодным. Поскольку катодный и анодный процессы разделены на поверхности, то разделены и противоположные потоки ионов, атомов и молекул. Разделенные потоки не мешают друг другу и по этой причине процесс коррозии протекает быстрее, чем в случае отсутствия микрогальванических элементов. Конечно, в настоящее время теории электрохимической коррозии выглядят гораздо более совершенными. Они основаны на многочисленных экспериментальных фактах и выражены в математической форме. Здесь мы не имеем возможности углубляться в детали.
Под электрохимической коррозией подразумевают процесс взаимодействия металлов с электролитами в виде водных растворов, реже с неводными электролитами, например, с некоторыми органическими электропроводными соединениями или безводными расплавами солей при повышенных температурах.
Причиной электрохимической коррозии является возникновение на поверхности металла короткозамкнутых гальванических элементов.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро-, а макрогальванопара, и коррозия называется контактной.
Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь).
Электрохимическая коррозия:
· гальванокоррозия (аналогична работе гальванического элемента);
· электрокоррозия (представляет собой электролиз).
Электрохимическая коррозия гораздо активнее химической коррозии.
1. Гальванокоррозия.
Гальванокоррозия вызывается многими причинами.
Основная причина возникновения гальванокоррозии - тесный контакт двух металлов с различными потенциалами, находящихся в среде электролита.
Металлы, находящиеся в тесном контакте (спай), образуют короткозамкнутый гальванический элемент.
Например, спай алюминия с медью.
По соотношению потенциалов алюминий является анодом, медь - катодом.
Рассмотрим данную гальванопару в кислой среде:

Разрушается анод, в данном случае алюминий.
Второй причиной возникновения гальванокоррозии является неоднородность металлов. Больше всего это относится к техническому железу - чугунам и сталям.
Техническое железо состоит в основном из кристаллов железа и участков цементита.

Кристаллы железа играют роль микроанодов, участки цементита - микрокатодов.
Рассмотрим данную систему в окружающей среде: воздухе с содержащейся в нём влагой (О2+2Н2О).

Следующей распространённой причиной возникновения гальванокоррозии является аэрация - неравномерный доступ кислорода (или воздуха) к разным участкам одного и того же металла.
Примером может служить вбитый во влажное дерево гвоздь. Та часть изделия (гвоздя), к которой доступ воздуха свободен, является катодом. Часть гвоздя, находящаяся в дереве, является анодом. Возникает коррозия:

Почему гвоздь во влажной древесине доски ржавеет и через некоторое время полностью превращается в бурую непрочную массу (рис. 5)?

Рис. 5. Схема образования ржавчины на железном гвозде
В кристаллической решетке железа находятся ионы и электроны:
Fe (кр.) – 2 е = Fe2+ (кр.).
Для электрохимической коррозии железа необходимы вода и кислород воздуха. Начало коррозии заложено в известном вам процессе самопроизвольного перехода ионов Fe2+ в раствор:
Fe (кр.) – 2 e = Fe2+ (р-р).
Ионы Fe2+ диффундируют по влажной древесине и одновременно переходят в ионы Fe3+:
Fe2+ – е = Fe3+.
Этот переход совершается благодаря тому, что кислород воздуха, реагируя с водой, использует образовавшиеся электроны:
О2 + 2Н2О + 4 е = 4ОН–.
Далее ионы Fe3+ образуют с ионами ОН– тригидроксид железа:
Fe3+ + 3ОН– = Fe(ОН)3.
Это самая примитивная схема ржавления железа. Одновременно протекают многочисленные параллельные и последовательные реакции. Ионы Fe2+ и Fe3+ гидролизуются с образованием основных ионов и гидроксидов Fe(ОН)2 и Fe(ОН)3. Гидроксид Fe(ОН)3 может быть представлен также формулой 2Fe(ОН)3 или Fe2О3•3Н2О. Это одна из формул вещества ржавчины. В действительности состав тригидроксида железа или гидратированного триоксида железа неопределенен: Fe2О3• n Н2О.
К этим реакциям добавляются реакции гидроксидов и основных ионов с углекислым газом, в результате чего образуются основные соли железа типа Fe(ОН)СО3 или (Fе(ОН)2)2СО3.
Приведенные выше реакции взаимосвязаны, и все смещают равновесие перехода ионов железа в раствор.
Суммарно и приближенно процесс ржавления железа может быть выражен следующим уравнением:
4Fe +2H2O + 3O2 = 2(Fe2О3•Н2О) (ржавчина).
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9–10 коррозия железа практически прекращается (рис. 6):
4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+.

Рисунок 6.
Коррозия железа кислородом воздуха, растворенным в воде.
2. Электрокоррозия - это коррозия материалов под влиянием электрического тока от внешнего источника (коррозия блуждающих токов).
Источниками блуждающих токов являются:
· весь электротранспорт,
· электроаппараты, работающие на земле.
Поток электронов, идущий по рельсу, встречая какое -- либо омическое сопротивление, например стык, уходит в почву. Этот участок рельса становился катодом по отношению к близко расположенному участку трубопровода.
Почва по своему составу является прекрасным проводником электронов. В почве такой поток электронов может пройти десятки километров. На своём пути поток электронов встречает какой-либо металлический предмет, например, трубопровод, и входит в него.
Данный участок трубопровода становится анодом и начинает разрушаться:
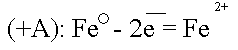
Ионы Fe уходят в землю, а поток электронов направляется далее по трубопроводу до тех пор, пока не встретит какое-либо новое сопротивление.
Встретив сопротивление, электроны уходят в землю, превращая данный участок трубопровода в катод. Поток электронов может войти в тот же рельс, откуда он вышел, превращая его в анод. Катодный процесс зависит от состава почвы.
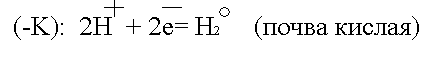
или
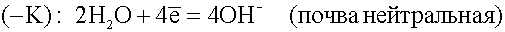 .
.
Итак, процессы электрохимической коррозии протекают по законам электрохимической кинетик и, когда общая реакция взаимодействия может быть разделена на следующие, в значительной степени самостоятельные, электродные процессы:
· анодный процесс - переход металла в раствор в виде ионов (в водных растворах, обычно гидратированных) с оставлением эквивалентного количества электронов в металле;
· катодный процесс - ассимиляция появившихся в металле избыточных электронов деполяризаторами.
Так же различают следующие типы электрохимической коррозии, имеющие наиболее важное практическое значение.
1. Коррозия в электролитах. К этому типу относятся коррозия в природных водах (морской и пресной), а также различные виды коррозии в жидких средах. В зависимости от характера среды различают:
а) кислотную;
б) щелочную;
в) солевую;
г) морскую коррозию.
По условиям воздействия жидкой среды на металл этот тип коррозии также характеризуется как:
· коррозия при полном погружении;
· при неполном погружении;
· при переменном погружении.
Каждый из этих подтипов имеет свои характерные особенности.
2. Почвенная (грунтовая, подземная) коррозия - воздействие на металл грунта, который в коррозионном отношении должен рассматриваться как своеобразный электролит.
Характерной особенностью подземной электрохимической коррозии является большое различие в скорости доставки кислорода (основной деполяризатор) к поверхности подземных конструкций в разных почвах (в десятки тысяч раз). Значительную роль при коррозии в почве играет образование и функционирование макрокоррозионных пар вследствие неравномерной аэрации отдельных участков конструкции, а также наличие в земле блуждающих токов. В ряде случаев на скорость электрохимической коррозии в подземных условиях оказывает существенное влияние также развитие биологических процессов в почве.
3. Атмосферная коррозия - коррозия металлов в условиях атмосферы, а также любого влажного газа; наблюдается под конденсационными видимыми слоями влаги на поверхности металла (мокрая атмосферная коррозия) или под тончайшими невидимыми адсорбционными слоями влаги (влажная атмосферная коррозия).
Особенностью атмосферной коррозии является сильная зависимость ее скорости и механизма от толщины слоя влаги на поверхности металла или степени увлажнения образовавшихся продуктов коррозии.
4. Коррозия в условиях механического воздействия. Этому типу разрушения подвергаются многочисленные инженерные сооружения, работающие как в жидких электролитах, так и в атмосферных и подземных условиях. Наиболее типичными видами подобного разрушения являются:
§ Коррозионное растрескивание; при этом характерно образование трещин, которые могут распространяться не только межкристально, но также и транскристально. Примером подобного разрушения является щелочная хрупкость котлов, сезонное растрескивание латуней, а также растрескивание некоторых конструкционных высокопрочных сплавов.
§ Коррозионная усталость, вызываемая воздействием коррозионной среды и знакопеременных или пульсирующих механических напряжений. Этот вид разрушения также характеризуется образованием меж- и транскристаллитных трещин. Разрушения металлов от коррозионной усталости встречаются при эксплуатации различных инженерных конструкций (валов гребных винтов, рессор автомобилей, канатов, штанг глубинных насосов, охлаждаемых валков прокатных станов и др.).
§ Коррозионная кавитация, являющаяся обычно следствием энергичного механического воздействия коррозионной среды на поверхность металла. Подобное коррозионно-механическое воздействие может приводить к весьма сильным местным разрушениям металлических конструкций (например, для гребных винтов морских судов). Механизм разрушения от коррозионной кавитации близок к разрушению от поверхностной коррозионной усталости.
§ Коррозионная эрозия, вызываемая механическим истирающим воздействием другого твердого тела при наличии коррозионной среды или непосредственным истирающим действием самой коррозионной среды. Это явление иногда называют также коррозионным истиранием или фреттинг-коррозией.
Дата добавления: 2015-07-11; просмотров: 571 | Нарушение авторских прав