
|
Читайте также: |
Водные растворы солей часто могут быть кислыми или щелочными в зависимости о природы кислоты и основания. из которых образована соль. Кислотность или щелочность водных растворов солей обусловлена протеканием в них реакции гидролиза. Гидролиз соли - это реакция взаимодействия соли с водой, приводящая, в зависимости от природы соли, к образованию кислоты и основания. Таким образом, гидролиз – это процесс, обратный нейтрализации (реакции между кислотой и основанием с образованием воды, сопровождающейся выделением теплоты). Гидролиз солей, как правило, сопровождается изменением рН их водных растворов.
нейтрализация -->
ΔН > 0; кислота + основание <-----------> соль + вода; ΔН < 0.
<-- гидролиз
Так как большинство солей – сильные электролиты и находятся в водном растворе в виде ионов, то уравнения реакции гидролиза можно записать как реакцию между ионами, образующими соль, и молекулами воды.
Гидролиз – обратимый процесс, и поэтому только часть молекул соли, присутствующих в растворе, подвергается гидролизу. Показателем глубины протекания гидролиза является степень гидролиза ß, представляющая собой отношение концентрации гидролизованных молекул Сгидр к исходной концентрации молекул электролита С:
ß = Сгидр/С.
Степень гидролиза, как правило, невелика, причина этого заключается в том, что один из участников реакции – вода является очень слабым электролитом. Поэтому положение равновесия реакции гидролиза сильно смещено в сторону исходных веществ. Степень гидролиза увеличивается с разбавлением раствора и повышением температуры, поскольку гидролиз – процесс эндотермический.
Степень гидролиза соли зависит от того, насколько слабыми электролитами являются образующие соль основание и кислота. Кроме того, если в результате гидролиза образуются, например, летучие вещества, равновесие смещается вправо и гидролиз может пойти практически до конца.
Если рассматривать соли как продукты взаимодействия кислот с основаниями, то природа продуктов реакции и величина рН получающегося при растворении соли в воде раствора зависят от сочетания силы кислоты и основания, образующих соль, поэтому возможны четыре варианта гидролиза солей.
1. Соли, образованные сильной кислотой и сильным основанием (NaCl, K2SO4, NaNO3 и др.). Такие соли не подвергаются гидролизу, так как не взаимодействуют с водой с образованием слабых электролитов, и их растворы нейтральны (рН = 7).
2. Соли, образованные слабой кислотой и сильным основанием (KCN, CH3COONa, Na2CO3 и др.). Гидролиз такой соли рассмотрим на примере цианида натрия. В системе, состоящей из NaCN и воды, происходят следующие процессы диссоциации:
NaCN = Na++ CN-,
H2O « OH-+ H+.
В этом случае происходит связывание ионов Н+с ионами CN- в молекулы очень слабой синильной кислоты (HCN). В результате в растворе увеличивается концентрация ионов ОН-, так как произведение [H+][OH-] – величина постоянная. Поэтому раствор проявляет щелочные свойства (рН > 7). Уравнение гидролиза этой соли имеет вид
NaCN + H2O «NaOH + HCN.
В ионной форме Na++ CN-+ H2O «Na++ OH-+ HCN.
В сокращенной ионной форме CN-+ H2O «OH-+ HCN.
Запишем выражение для константы равновесия реакции гидролиза:
Kc = 
или в общем виде для реакции гидролиза аниона слабой кислоты HA
А-+ H2O «OH-+ HA,
Kc = 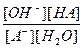 .
.
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза (Кг):
Kc[H2O] = Кг = 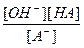 .
.
Умножая числитель и знаменатель на равновесную концентрацию ионов водорода, получаем
Кг =  .
.
Как указывалось ранее [H+][OH-] = КН2О, а отношение  является константой диссоциации Кд слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
является константой диссоциации Кд слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Кг = КН2О/Кд. (2.5)
Гидролиз солей многоосновных слабых кислот идет обычно в несколько стадий, и продуктами гидролиза являются кислые соли. Например, гидролиз карбоната калия идет в две стадии:
1) K2CO3 + H2O «KHCO3 + KOH,
В ионной форме 2K++ CO32-+ H2O «K++ HCO3-+ K++ OH-.
В сокращенной ионной форме CO32-+ H2O «HCO3-+ OH-;
2) KHCO3 + H2O «H2CO3 + KOH.
В ионной форме K++ HCO3-+ H2O «H2CO3 + K++ OH-,
В сокращенной ионной форме HCO3-+ H2O «H2CO3 + OH-.
Степень гидролиза от первой стадии к последующей уменьшается.
В результате гидролиза солей, образованных слабой кислотой и сильным основанием, их растворы обнаруживают щелочную реакцию (рH > 7).
3. Соли, образованные сильной кислотой и слабым основанием (ZnCl2, Al2(SO4)3, Cu(NO3)2). Гидролиз такой соли рассмотрим на примере хлорида аммония:
NH4Cl = Cl-+ NH4+,
H2O «H++ OH-.
В этом случае происходит связывание ионов ОН-ионами NH4+ в молекулы слабого основания NH4OH. В растворе преобладают ионы Н+и проявляются кислотные свойства (рН < 7).
Уравнение гидролиза NH4Cl + H2O «NH4OH + HCl.
В ионной форме NH4++ Cl-+ H2O «NH4OH + H++ Cl-.
В сокращенной ионной форме NH4++ H2O «NH4OH + H+.
В выражение для константы гидролиза (2.5) в этом случае входит константа диссоциации слабого основания.
Гидролиз солей многовалентных металлов протекает по стадиям. На первой стадии образуется основная соль. Например, гидролиз ZnCl2 идет в две стадии:
1) ZnCl2 + H2O «Zn(OH)Cl + HCl
В ионной форме Zn2++ 2Cl-+ H2O «Zn(OH+)+ H++ 2Cl-
В сокращенной форме Zn2++ H2O «(ZnOH+)+ H+
2) Zn(OH)Cl + H2O «Zn(OH)2 + HCl
В ионной форме Zn(OH+) + Cl-+ H2O «Zn(OH)2 + H++ Cl-
В сокращенной ионной форме Zn(OH+)+ H2O «Zn(OH)2 + H+.
Следовательно, растворы солей, образованных сильной кислотой и слабым основанием, имеют кислотную реакцию (рН < 7).
4. Соли, образованные слабой кислотой и слабым основанием (NH4CN, CH3COONH4). Такие соли подвергаются гидролизу наиболее полно:
NH4CN = NH4+ + CN-,
H2O «OH- + H+.
В этом случае образуются одновременно молекулы слабых электролитов NH4OH и HCN и происходит связывание как ионов Н+, так и ионов ОН-. Раствор будет проявлять слабокислотные или слабощелочные свойства в зависимости от того, кислота или основание имеет более высокое значение константы диссоциации.
Раствор NH4CN имеет слабощелочную реакцию, так как константа диссоциации NH4OH больше, чем у HCN (табл. 3, прил. 2.16).
Уравнение гидролиза NH4CN + H2O «NH4OH + HCN.
В ионной форме NH4++ CN-+ H2O «NH4OH + HCN.
Совместный гидролиз солей. При совместном присутствии в растворе двух солей, одна из которых образована слабой кислотой, а другая – слабым основанием, идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О.
Например, нитрат алюминия Al(NO3)3 – соль, образованная слабым основанием, гидролизуется следующим образом:
Al3+ + Н2О «AlOH2+ + H+.
Карбонат натрия Na2СO3 - соль, образованная слабой кислотой, гидролизуется следующим образом:
CO32-+ H2O «HCO3-+ OH-.
При сливании растворов этих солей гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца.
Молекулярное уравнение
2Al(NO3)3 + 3Na2СO3+ 3Н2О = Al(OH)3 ¯+ 3CO2+ 6КNO3.
Ионно-молекулярное уравнение
2Al3+ + 3CO32-+ 3Н2О = Al(OH)3 ¯+ 3CO2.
Процесс гидролиза практически заканчивается на первой – второй стадии из-за смещения равновесия в обратном направлении при увеличении или уменьшении рН, вызванном гидролизом.
Вопросы для самоконтроля
1. Каков механизм электролитической диссоциации? Как зависит этот процесс от характера связей в молекуле и диэлектрической проницаемости растворителя?
2. Дайте определение кислоты, гидроксида и соли с точки зрения электролитической диссоциации.
3. Чем отличаются сильные и слабые электролиты?
4. Что такое константа диссоциации электролита и о чем можно судить по ее величине?
5. Какова зависимость между степенью диссоциации, константой диссоциации и концентрацией раствора слабого бинарного электролита?
6. Что называется активностью и коэффициентом активности сильного электролита?
7. Как влияет на равновесие электролитической диссоциации введение в раствор электролита одноименного иона?
8. В чем особенности ионных равновесий в растворах амфотерных электролитов?
9. Что такое «произведение растворимости»? Как оно связано с растворимостью?
10. Что такое ионное произведение воды и водородный показатель?
11. В каком случае имеет место гидролиз солей?
Литература
1. Глинка Н.Л. Общая химия. - М; Интегралл-Пресс, 2002, гл. 8, § 8.1 … 8.12.
2. Коровин Н.В. Общая химия. - М; Высш. шк., 2002, гл. 8, §8.4 … 8.6.
Дата добавления: 2015-07-10; просмотров: 146 | Нарушение авторских прав