
Читайте также:
|
В насыщенных растворах малорастворимых солей (напомним, что все соли – это сильные электролиты), кристаллы которых построены из ионов, устанавливается равновесие между гидратированными ионами и ионами в кристаллах (твердая фаза). Насыщенный раствор получается тогда, когда дальнейшее растворение данного вещества в растворе прекращается. В насыщенном растворе концентрация этого вещества максимальна при данных условиях. Концентрация вещества в его насыщенном растворе называется его растворимостью Ср. Растворимость выражается в моль/л или г/л. Так, в насыщенном растворе электролита AnBm, находящегося в равновесии с его твердой фазой имеет место следующее равновесие:
растворение
 AnBm nAm++ mBn-
AnBm nAm++ mBn-
твердая фаза кристаллизация насыщенный раствор
Поскольку в растворах сильных электролитов состояние ионов определяется их активностями, то константа равновесия этого процесса выразится следующим уравнением:
К=  .
.
Прямой и обратный процессы являются гетерогенными, так как протекают на поверхности осадка. Знаменатель этой дроби, т.е. активность твердого вещества, есть величина постоянная, поэтому, произведение К.аАnBm тоже величина постоянная при данной температуре. Отсюда следует, что произведение активностей ионов тоже представляет собой постоянную величину, называемую произведением растворимости (ПР):
ПР = a nAm+ × a mBn- . (2.3)
Произведение растворимости малорастворимого электролита равно произведению концентраций его ионов в насыщенном растворе в степенях их стехиометрических коэффициентов.
Если сильный электролит малорастворим, то концентрация его ионов в насыщенном растворе незначительна и коэффициент активности близок к единице (g = 1), поэтому активности заменяют молярными концентрациями ионов.
Например, в насыщенном растворе сульфата бария устанавливается равновесие:
ВaSO4 «Ba2+ + SO42-.
твердая фаза насыщенный раствор
Произведение растворимости имеет вид: ПР = [Ba2+] × [SO42-].
Эта величина постоянна при данной температуре. Значения величин произведений растворимости малорастворимых солей и оснований для стандартных условий сведены в таблицы (табл.4, прил. 2.16).
ПРBaSO4 = 1,08 × 10-10.
В насыщенном растворе фосфата кальция устанавливается равновесие:
Сa3(РO4)2 «3Сa2+ + 2РO43-.
твердая фаза насыщенный раствор
Произведение растворимости имеет вид:
ПРСa3(РO4)2 = [Сa2+]3 × [РO43-]2.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций (ПК) ионов электролита становится больше ПР, такой раствор называется перенасыщенным. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение величины произведения концентраций (ПК) ионов малорастворимого электролита над его произведением растворимости:
ПК > ПР.
В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Условие ПК = ПР соответствует насыщенному раствору.
Если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка. Следовательно, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР:
ПК < ПР.
Рассмотрим гетерогенное равновесие, устанавливающееся между насыщенным раствором электролита (AnBm) и его осадком:
AnBm «nAm+ + mBn-
Ср nСр mСр
твердая фаза насыщенный раствор
Произведение растворимости связано с растворимостью S, выраженной в моль/л. Исходя из значений ПР можно вычислять растворимость малорастворимых электролитов, и наоборот, зная растворимость, рассчитывать ПР:
ПРAnBm = [Am+]n [Bn-]m = (n Ср)n(m Ср)m= nnmm Ср n+m,
Ср = 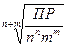 . (2.4)
. (2.4)
Дата добавления: 2015-07-10; просмотров: 149 | Нарушение авторских прав