
|
Читайте также: |
0,5 UO2 + CO = 0,5 U + CO2
Получаем:

Значения lgK4 даются в табл. 7.
Таблица 7
| Т 0К | ||
| lgK3 | -13,90 | -6,76 |
Из этой таблицы видно, что при всех температурах К4 – величина малая. Если произвести расчет состава равновесной газовой фазы, то получим, что при всех температурах газовая фаза практически состоит из одной окиси углерода.
Поэтому окисью углерода нельзя восстановить двуокись урана до металлического урана.
Суммируя сказанное выше, можно сделать следующие выводы:
1. Высшие окислы урана термодинамически легко восстанавливаются до двуокиси урана.
2. Двуокись урана не может быть окислена с помощью двуокиси углерода.
3. Окисью углерода нельзя восстановить двуокись урана до металлического урана.
1.5. Восстановление окислов урана водородом.
Совокупность реакций, протекающих при действии водорода на окислы урана, может быть записана следующим образом:
1) 3 UO3 + H2 = U3O8 + H2O
2) 0,8 U3O8 + H2 = 0,6 U4O9 + H2O
3) U4O9 + H2 = 4 UO2 + H2O
4) 0,5 UO2 + H2 = 0,5 U + H2O
Константа равновесия для любой из этих реакций

Термодинамический анализ этих реакций осуществляем также, как и в случае восстановления окисью углерода. При этом для реакции:
H2 + 0,5 O2 = H2O
Имеем

Для реакции восстановления окислов урана водородом получаем:


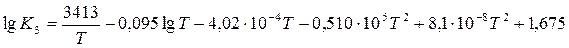

Значения констант равновесия, полученные по этим уравнениям, приведены в табл. 8.
Таблица 8
| lgK | T 0K | ||
| lgK1 | 17,43 | 9,83 | 7,29 |
| lgK2 | 11,97 | 6,67 | 4,83 |
| lgK3 | 7,85 | 4,42 | 3,80 |
| lgK4 | - | -14,12 | -9,20 |
На основании этих данных можно сделать выводы, аналогичные тем, которые были сделаны при анализе процессов восстановления с помощью окиси углерода, а именно:
Реакции 1, 2, 3 необратимы и протекают только слева направо. Реакция 4 слева направо не протекает.
Аналогичные выводы были сделаны при термодинамическом анализе процессов восстановления окислов урана аммиаком и метаном. Поэтому обобщая, можно сделать следующие выводы:
1. Косвенное восстановление высших окислов урана термодинамически осуществляется легко; все реакции восстановления этих окислов относятся к числу необратимых и могут протекать только слева – направо. Двуокись урана нельзя окислять двуокисью углерода и водяным паром.
2. Косвенным путем двуокись урана не восстанавливается до металлического урана. Окисление металлического урана двуокисью углерода и водяным паром протекает только до двуокиси урана.
1.6. Углетермическое восстановление двуокиси урана.
В общем виде реакцию прямого восстановления можно записать так:
МеО(тв) + С(тв) = Ме(тв) + СО(газ)
При термодинамическом анализе считаем, что эта реакция осуществляется через следующие два процесса:
а) МеО(тв)+ СО(газ)= Ме(тв)+ СО2 (газ)
б) С(тв) + СО2 (газ) = 2СО(газ)
а) + б) МеО(тв)+ С(тв) = Ме(тв)+ СО
Для того, чтобы суммарная реакция протекала слева направо, т.е. в сторону восстановления, необходимо чтобы обе промежуточные реакции протекали в этом направлении. Посмотрим при каких же условиях эти реакции будут протекать слева направо. Реакция (а) протекает в строну восстановления только тогда, когда фактическое содержание окиси углерода в газовой фазе больше равновесного по этой реакции. Реакция (б) протекает слева направо тогда, когда фактическое содержание окиси углерода меньше равновесного по данной реакции.
А отсюда следует, что углетермическое восстановление окисла возможно тогда, когда содержание окиси углерода в газовой фазе больше равновесного по реакции косвенного восстановления и меньше равновесного по реакции газификации углерода двуокисью углерода.
Для анализа промежуточных реакций воспользуемся правилом фаз. Реакция (а) протекает без изменения числа газовых молекул. Поэтому
f = K - P + 1, K = 3, P = 3, f = 1.
Система обладает одной степенью свободы – моновариантна. В качестве независимого параметра считаем температуру. Тогда состав равновесной газовой фазы есть функция температуры.
Реакция (б) протекает с изменением числа газовых молекул. Поэтому давление оказывает влияние на равновесные системы и
f = K – P +2, K = 2, P = 2, f = 2.
Данная система биварианта. Следовательно, имеются два независимых параметра: температура и давление. Состав же равновесной газовой фазы является функцией температуры и давления. Посмотрим как меняется состав газовой фазы при постоянной температуре с изменением давления. На основании принципа Ле-Шателье – Вант-Гоффа при увеличении давления равновесие сдвигается справа налево, т.е. в сторону уменьшения общего числа газовых молекул. А отсюда следует, что с повышением давления содержание окиси углерода в газовой фазе уменьшается, а двуокиси углерода увеличивается.
Известно, что реакция газификации углерода (реакция б) протекает с поглощением тепла – реакция эндотермическая. Поэтому при постоянном давлении с повышением температуры содержание окиси углерода возрастает. Сказанное можно проиллюстрировать следующим графиком (рис. 7). Причем Р1 < Р2 < Р3. Из этого графика следует, что прямое (углетермическое) восстановление становится возможным, начиная с некоторой температуры Т1. Причем чем меньше общее давление в системе, тем ниже эта температура.
Перейдем теперь к рассмотрению углетермического восстановления двуокиси урана
0,5 UO2(тв) + C(тв) = 0,5U(тв) + СО(газ)
Представим эту реакцию, как сумму двух следующих реакций:
а) 0,5UO2(тв) + СО(газ) = 0,5U(тв) + СО2
б) C(тв) + СО2(газ) = 2 СО(газ)

Рис. 7
Тогда:

К – константа равновесия для реакции углетермического восстановления;
Ка – константа равновесия для реакции косвенного восстановления;
Кб – константа равновесия для реакции газификации углерода двуокисью углерода.
Так как обычно общее давление невелико, то активности твердых фаз равны единице, а активность компонента газовой фазы – парциальному давлению. Поэтому К = РСО.
Зависимость lgKа от температуры была дана выше. Реакция
С + СО2 = 2СО
хорошо изучена экспериментально и для нее дается следующее уравнение

Подсчитанное таким образом значение lgK = lg PCO приводится в табл. 9.
Таблица 9
| T 0K | ||||
| lgP0 (ат) | -2,4 | -1,1 | 0,4 | 2,3 |
| PCO | 3 мм.рт.ст. | 60 мм.рт.ст. | 2,52 ат. | - |
Но при изучении углетермического восстановления двуокиси необходимо иметь в виду, что уран образует с углеродом карбиды.
В системе U – C существуют три химических соединения: UC – монокарбид, U2C3 – полуторный карбид, UC2 – дикарбид.
Карбид урана впервые был получен Муаосаном и ему была приписана формула U2C3. Однако в более поздних работах было показано, что эта фаза представляет собой скорее UC2. Наконец, рентгеновскими исследованиями определенно доказано существование UC2, а также монокарбида UC.
Монокарбид урана UC. Пирофорное вещество серого цвета, имеющее кубическую решетку типа NaCl с четырьмя молекулами в элементарной ячейке. Параметр решетки а = 4,9605±0,0002Å. Температура плавления UC, по данным различных авторов, колеблется в пределах 2280 - 2590°С.
Как известно, твердые соединения ряда металлов с углеродом входят в своеобразную группу веществ, именуемую фазами внедрения. Монокарбид урана – типичная фаза внедрения. Структура дефектна по углероду.
Проводимость в монокарбида носит металлический характер и осуществляется свободными электронами. Она сильно зависит от дефектности решетки.
U2C3– полуторный карбид урана. В настоящее время считается, что U2C3 существует в виде устойчивого соединения при температурах ниже 1800°С.
U2C3 имеет объемноцентрированную кубическую решетку с параметром а=8,088±0,001Å.
В элементарной ячейке содержится восемь молекул. Рентгеновская плотность d=12,88 г/см3. U2C3 устойчив до температуры разложения (1730°С), не претерпевает никаких полиморфных превращений. Существует в виде стехиометрического соединения U2C3.
UC2 – дикарбид урана. Существует в виде двух кристаллических модификаций: низкотемпературной и высокотемпературой. Низкотемпературная модификация имеет тетрагональную структуру с постоянными: а=3,517±0,001Å и с=5,987±0,001Å. При прокаливании UC2 до 1820±20°С происходит аллотропическое превращение с переходом тетрагональной модификации в кубическую. Тип кубической тетрагональной модификации UC2 точно не установлен.
Рентгеновская плотность дикарбида урана d=11,67 г/см3.
Учитывая наличие карбидов урана, можно ожидать, что восстановление двуокиси урана углеродом будет протекать более вероятно с образованием карбида, а не металлического урана. Рассмотрим возможные при этом реакции. Углетермическое восстановление двуокиси урана с образованием монокарбида урана протекает по реакции:
UO2 + 3C = UC + 2CO
константа равновесия К = Р2СО.
Зависимость равновесного давления окиси от температуры выражается уравнением

Для интервала температур 1750 – 2080 К Стерлин приводит более простое уравнение

При 2070 РСО(равн.) = 1 атм.
Рядом исследователей отмечается полное завершение этой реакции при температурах 2070 – 2270 0К.
В некоторых работах указывается, что вначале восстановление UO2 углеродом происходит с образованием дикарбида урана по реакции:
UO2 + 4C = UC2 + 2CO
К = Р2СО.
Стандартное изменение изобарного потенциала
∆Z0 = 164500 – 1433*T
при 2214 0К – ∆Z0 = 0. В дальнейшем восстановление происходит за счет взаимодействия
UO2 + 3UC2 = 4UC + 2CO
для которого:
∆Z0 = 152200 – 6542*T,
при 2325 0К – ∆Z0 = 0.
Дата добавления: 2015-10-28; просмотров: 271 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Восстановление трехокиси урана | | | ОСНОВЫ МЕТАЛЛОТЕРМИИ |