
|
Читайте также: |
Визначення поверхневого натягу на межі поділу фаз «рідина-пара». Перевірка правила Дюкло-Траубе
Мета роботи: визначення поверхневого натягу на межі «рідина-пара», перевірка правила Дюкло-Траубе, розрахування параметрів молекул ПАР.
1.Основні теоретичні положення
Енергетичний стан молекул речовини об`ємної фази та поверхневого шару різний. Поверхневий шар молекул твердого тіла або рідини характеризується надлишком вільної енергії Гіббса порівняно з молекулами об`ємної фази. Наявність цього надлишку обумовлена неповною скомпенсованістю міжмолекулярних сил притягання у молекул поверхневого шару внаслідок їх слабкої взаємодії з молекулами сусідньої фази.
Згідно з другим законом термодинаміки будь-яка система прагне самовільно зменшити свій запас вільної енергії. Стосовно межі поділу фаз «рідина-газ» (або «рідина-вакуум») це означає, що при наявності надлишку вільної поверхневої енергії кожна рідина прагне спонтанно скоротити свою поверхню до мінімально можливого за даних умов значення.
Важливою енергетичною характеристикою поверхні є поверхневий натяг s - вільна поверхнева енергія одиниці поверхні:
s = 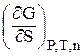 , Дж/м2. (2.1)
, Дж/м2. (2.1)
З іншого боку, поверхневий натяг являє собою силу, яка діє на поверхні (у напрямку дотичної до неї) та прагне скоротити поверхню до найменших можливих розмірів при даному об’ємі. У цьому випадку [s] = Н/м.
Поверхнева енергія і, як наслідок, поверхневий натяг залежать від температури, природи межі поділу фаз, природи та концентрації розчинених речовин.
Вплив природи речовини на адсорбцію можна кількісно описати за допомогою так званої поверхневої активності g:
g = tga = Ds/DC (C®0)
    s s
 a
C
Рис. 4. Графічне визначення
поверхневої активності g a
C
Рис. 4. Графічне визначення
поверхневої активності g
|
g = 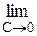
 , (2.2)
, (2.2)
яка є граничним значенням прирощення поверхневого натягу при концентрації, близької до нуля.Графічно вона визначається як тангенс кута нахилу дотичної, проведеної до кривої s = f(С) у точці перетинання її з віссю ординат (рис. 4).
Поверхневий натяг розчинів, як правило, відрізняється від поверхневого натягу чистого розчинника. Залежність поверхневого натягу розчину від концентрації розчиненої речовини (при Т=const) називають ізотермою поверхневого натягу. Для водних розчинів розрізняють 3 основних типи ізотерм поверхневого натягу (рис. 5.).
s 1
С Рис.5. Основні типи ізотерм поверхневого натягу для водних розчинів |
Ізотерма 1 характерна для поверхневого натягу розчинів сильних неорганічних електролітів. Оскільки іони добре гідратуються, то співвідношення енергій Е в системі вода - електроліт можна виразити нерівністю  . Наслідком гідратації є інтенсивне «втягнення» молекул води з поверхні в глибину фази.
. Наслідком гідратації є інтенсивне «втягнення» молекул води з поверхні в глибину фази.
Ізотерми 2 та 3 характерні для поверхневого натягу розчинів так званих поверхнево-активних речовин. До останніх відносять органічні речовини з полярною асиметрією молекули. Полярні групи (-СООН, -ОН, -NH2, -CHO, -SO3H та ін.), на відміну від гідрофобних радикалів є гідрофільними. Це призводить до певної орієнтації молекул ПАР у поверхневому шарі (рис. 6).
Повітря - полярна група
Розчин - гідрофобний радикал Рис. 6. Орієнтація молекул ПАР при граничній адсорбції. |
Отже, дифільність молекул ПАР обумовлює зміну будови поверхневого шару межі поділу «розчин-газ» в порівнянні з межею «вода-газ» і, як наслідок, зниження поверхневого натягу s, оскільки  . Для оцінки поверхневої активності водних розчинів речовин дифільної будови (спирти, кислоти, аміни і т.п.) при кімнатній температурі можна застосовувати правило Дюкло-Траубе. Згідно з ним, починаючи з третього члена гомологічного ряду ПАР, поверхнева активність зростає у середньому в 3,2 рази при збільшенні вуглеводневого ланцюга на групу (-СН2-). При температурах, вищих за кімнатну, коефіцієнт 3,2 зменшується, наближаючись до 1.
. Для оцінки поверхневої активності водних розчинів речовин дифільної будови (спирти, кислоти, аміни і т.п.) при кімнатній температурі можна застосовувати правило Дюкло-Траубе. Згідно з ним, починаючи з третього члена гомологічного ряду ПАР, поверхнева активність зростає у середньому в 3,2 рази при збільшенні вуглеводневого ланцюга на групу (-СН2-). При температурах, вищих за кімнатну, коефіцієнт 3,2 зменшується, наближаючись до 1.
Ізотерма 2 добре описується рівнянням Шишковського
s = sо - В.ln(1 + Ас), (2.3)
де А і В - константи; с - концентрація ПАР.
Ізотерма типу 3 характерна для розчинів міцелоутворюючих ПАР (див. лабораторну роботу 6).
Існує декілька способів експериментального знаходження поверхневого натягу рідин. Серед найбільш поширених методів можна назвати сталагмометричний метод (зважування (лічби) крапель), метод відриву кільця, метод відриву пластинки.
У даній роботі для визначення s використовується метод найбільшого тиску бульбочки газу. Визначення поверхневого натягу цим методом проводять за допомогою приладу Ребіндера (рис. 7). Основною частиною цього приладу є трубочка з капілярним кінчиком (6), яку поміщають у пробірку 3. При роботі приладу в пробірці над поверхнею рідини за допомогою розподільної лійки (аспіратора) 1 створюється вакуум (за рахунок витікання води). Над трубкою 6 тиск атмосферний, а в пробірці 3 повітря поступово розріджується. Найбільша різниця тиску забезпечує відрив бульбочки газу, яка утворюється на кінці капіляру.
                                                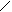                  5 5
 6 1 6 1
 3 3
 2 2
Рис 7. Прилад для визначення поверхневого натягу |
Поверхневий натяг s на межі «рідина-пара» прямо пропорційний максимальному тиску газу Р у момент відриву бульбочки від капіляра:
s =k.Р, (2.4)
де k - стала приладу.
Стала k визначається експериментально за тиском бульбочки газу у стандартній рідині з відомим значенням s при даній температурі. Для водних розчинів як стандартну рідину використовують воду, залежність поверхневого натягу якої від температури наведена в табл. 2. Для стандартної рідини sо= kРо, звідки k=sо/Ро. Тоді s=sоР/Ро. Тиск Р в системі вимірюють за допомогою похилого манометра 7, у якого один кінець стикається з атмосферою, а інший - з вакуумною системою. За допомогою крана 4 розрідження регулюють так, щоб було зручно рахувати бульбочки газу, що проскакують через капіляр.
Таблиця 2
Дата добавления: 2015-10-23; просмотров: 155 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Експериментальна частина | | | Експериментальна частина |