
|
Читайте также: |
Классическими работами советских ученых А.Е. Браунштейна и С.Р. Мар-дашева и американского биохимика А. Майстера доказана роль дикарбо-новыхаминокислот (глутаминовой и аспарагиновой кислот и их амидов – глутамина иаспарагина) в интеграции азотистого обмена в организме. Система дикарбоновых аминокислот, к которой относят также соответствующие α-кетокислоты, теснейшим образом связана не только с азотистым метаболизмомв целом, но и с обменом липидов и углеводов. Ранее отмечалась особая роль дикарбоновых аминокислот и ферментов, катализирующих их превращения, в перераспределении азота в организме, дезаминировании и синтезе природныхаминокислот (реакции трансде-заминирования и трансреаминирования), в образовании конечных продуктов белкового обмена – синтезе мочевины.
Основные катаболические пути превращения дикарбоновых аминокислот и их амидов могут быть представлены в виде следующих реакций:
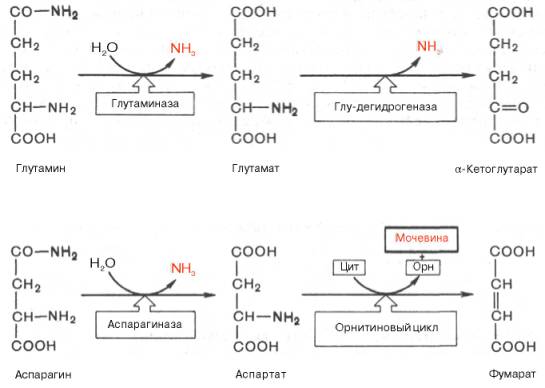
Аспарагиновая кислота принимает непосредственное участие в орни-тиновом цикле мочевинообразования, вреакциях трансаминирования и биосинтезе углеводов (гликогенная аминокислота), карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов (см. главу 14), а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга. Роль последней, содержащейся в довольно высоких концентрациях в ткани мозга млекопитающих, пока не выяснена.
Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участия в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин – это незаменимый источник азота в ряде синтезов, в частности в биосинтезе пуриновых и пиримидиновых нуклеотидов, амино-сахаров, в обезвреживании фенилуксусной кислоты (синтез фенилацетил-глутамина) у человека и человекообразных обезьян, а также в синтезе
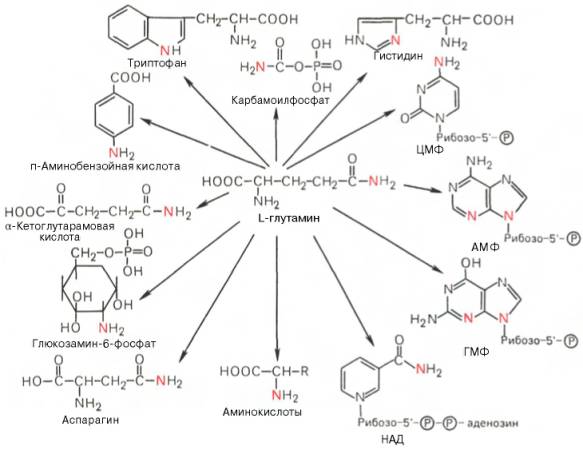
Рис. 12.8. Использование амидного азота глутамина для синтеза различных соединений в живых организмах.
витамина фолиевой кислоты (птероилглутаминовая кислота). На рис. 12.8 суммированы реакции синтеза рядавеществ, в которых амидный азот глутамина выполняет специфическую роль, незаменимую азотом другихаминокислот.
Глутамин и аспарагин оказались, кроме того, эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани; они не могут быть заменены ни друг другом, ни соответствующими дикарбоновыми аминокислотами. Это свидетельствует о том, что в условиях выращивания клеток в культуре тканинекоторые клетки теряют способность синтезировать эти амиды синтетазным или трансаминазным путем.
В лаборатории Майстера получены доказательства, что глутамин и аспарагин в животных тканях подвергаются сочетанному трансаминиро-ванию и дезамидированию под влиянием специфических трансаминаз амидов (глутаминтрансаминазы и аспарагинтрансаминазы) и неспецифической ω-амидазы:
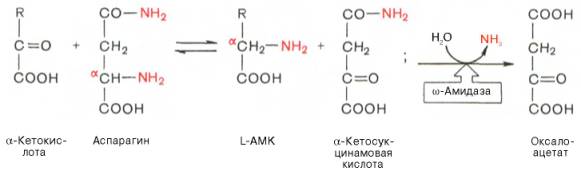
Таким образом, в реакции переноса участвует α-аминогруппа аспа-рагина, а не амидная группа, как предполагали раньше; в то же время амидная группа промежуточного соединения α-кетосукцинамовой кислоты в дальнейшем освобождается в процессе гидролиза в виде аммиака. Трансаминирование – обратимый процесс, поэтому лимитирующими факторами в синтезе аспарагина (и глутамина) являются ω-амиды оксалоаце-тата и α-кетоглутаровой кислоты, синтез которых в животных тканях пока не доказан.
Глутаминовая кислота является одним из немногих соединений, помимо глюкозы, которые служат энергетическим материалом для ткани мозга. Ранее была отмечена высокая активность в ткани мозга глутаматдекар-боксилазы, катализирующей превращение глутамата в γ-аминомасляную кислоту (ГАМК). Дальнейшее последовательноеокисление ГАМК включает трансаминирование с образованием полуальдегида янтарной кислоты, окисление вянтарную кислоту и, наконец, окисление через ЦТК.
В обеих реакциях (декарбоксилирование глутамата и трансаминиро-вание ГАМК) участвует пиридоксальфосфат, который оказался более прочно связанным с ГАМК-трансаминазой. ГАМК оказывает тормозящий эффект на синаптическую передачу в ЦНС, поэтому судорожные явления, наблюдаемые при недостаточности витамина В6, могут быть связаны со снижением образования ГАМК в глутаматдекарбоксилазной реакции. У животных судороги могут быть вызваны также введением изониазида, который связывает альдегидную группу кофермента илиантивитаминов В6, в частности метоксипиридоксина. ГАМК – естественно встречающийся «транквилизатор», поэтому одним из путей повышения ее концентрации в ЦНС является введение веществ, оказывающих тормозящее действие на ГАМК-трансаминазу, которая эффективно устраняет ГАМК.
В последние годы у бактерий и растений (но не в животных тканях) открыт совершенно новый путь синтезаглутаминовой кислоты из α-кето-глутаровой кислоты и глутамина. Этот путь, получивший название глута-матсинтазного цикла, включает две сопряженные с распадом АТФ необратимые реакции, ведущие к усвоению (ассимиляции) аммиака:
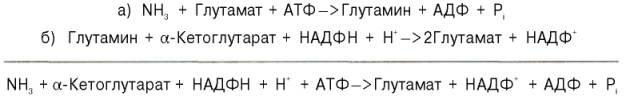
Первую стадию (а) катализирует глутаминсинтетаза, которая имеется в клетках животных, вторую (б) –глутаматсинтаза, открытая только у растений, грибов и микроорганизмов. Обе стадии могут быть представлены вместе с обратимо действующей глутаматдегидрогеназной реакцией (в) в виде следующей схемы:

Оказалось, что при низких концентрациях аммиака, характерных для растений и микроорганизмов, реакциипротекают преимущественно по глутаматсинтазному циклу, а при высоких его концентрациях, свойственных тканямживотных,– по глутаматдегидрогеназному пути; в обоих случаях синтезируется глутамат.
Дата добавления: 2015-09-01; просмотров: 91 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ТЕМА 12.2. ОБЕЗВРЕЖИВАНИЕ ПРОДУКТОВ КАТАБОЛИЗМА АМИНОКИСЛОТ В КИШЕЧНИКЕ | | | Распад белков и аминокислот |