
|
Читайте также: |
При восстановлении субстратов используют ряд методов:
1. Наиболее общий и экологически чистый метод – восстановление водородом на катализаторе. В качестве катализаторов используют:

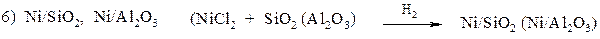

2. Каталитическо-химический. Восстановление проводят, как правило, на Ni Ренея. Источником водорода служат вещества, которые на катализаторе разлагаются с выделением водорода.
2.1. В первом методе водород образуется при разложении гидразин гидрата. В результате реакции выделяется аммиак, азот и водород:

2.2. Во втором методе водород образуется при разложении муравьиной кислоты на катализаторе:
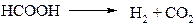
3. Электролитическое восстановление в воде. При этом различают два крайних случая.
3.1 Каталитический (электроды – Pt, Pd, Ni). Субстрат восстановления сорбируется на катоде и восстанавливается выделяющимся на электроде водородом.

Напряжение подбирается таким образом, чтобы происходил электролиз воды. В этом случае одновременно происходит выделение непрореагировавшего водорода.
3.2. Электрохимический (электроды – Pb, C). Субстрат также сорбируется на катоде, но электроны непосредственно передаются субстрату, который далее реагирует с водой.
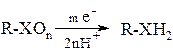
При этом выделения водорода практически не происходит.
4. Химические методы.
1) NaHSO3 + Na2SO3 (восстановление NO, N2+ - групп);
2) Na2S2O4 (восстановление NO, NO2, -S-S- групп);
3) NaHS (восстановление NO и одной из NO2 групп);
4) Fe/H2O/NH4Cl/NaCl (восстановление NO, NO2, -S-S- групп);
5) Zn + H+ (восстановление NO, NO2, -S-S- групп);
6) Sn, SnCl2 + H+ (восстановление NO, NO2, -S-S-, N2+ групп);
7) Al(i -О-C3H7)3 (восстановление карбонильных групп);
8) LiAlH4 (восстановление двойных связей, сложных эфиров);
9) NaBH4 (восстановление двойных связей, сложных эфиров).
При столь большом разнообразии методов выбор конкретного способа и реагентов зависит от ОВ потенциала субстрата, условий выделения конечного продукта, его устойчивости, возможности восстановления других группировок и, безусловно, от экономических и экологических факторов. При получении лекарственных средств необходимо избегать образования комплекса целевого продукта с солями тяжелых металлов. Восстановление оловом или дихлоридом олова часто удобно использовать в лабораторной практике, т. к. метод отличается высокой чистотой продукта и его высоким выходом. Однако в промышленности не рекомендуется использование олова из-за его высокой стоимости. Кроме того, по требованиям Фармакопеи содержание солей четырехвалентного олова в препарате не должно превышать 0,0001 %. Восстановление химическими реагентами проводят в обычной емкостной аппаратуре.
Гидрирование является наиболее экологически чистым методом, однако использование его требует сложной аппаратуры. Как правило, восстановление на никеле Ренея проводят при давлении водорода 4 – 10 МПа. Таким образом, для осуществления данного процесса необходимо использовать автоклавы, которые должны находиться в отдельном помещении. Перед началом гидрирования автоклав продувают азотом, а затем водородом. Сброс водорода осуществляют через трубу, выведенную на крышу цеха, снабженную гравийным фильтром. Водород получают электролизом воды. В связи с тем, что вода обладает малой электропроводностью, в процессе используют 25 % раствор гидроксида натрия. Выделяющиеся на электродах водород и кислород собирают в газгольдерах. Водород из газгольдера поступает на трехступенчатый компрессор, после каждой ступени сжатия его охлаждают в теплообменнике. После компрессии водород поступает на гребенку с баллонами. При электролизе расход электроэнергии на производство 1 м3 водорода при нормальном давлении составляет 4 – 6 квт/ч. Процесс восстановления ведут до прекращения падения давления водорода. После этого избыточный водород через ресивер направляют на продувку параллельного автоклава.
Приготовление катализаторов. В ХФП наиболее широко используется катализатор никель Ренея (НР). Его получают выщелачиванием алюминий никелевого сплава (70 % Al и 30 % Ni). Гранулы величиной 3 – 5 мм загружают в аппарат, который затем продувают азотом и медленно приливают из мерника 25 % раствор гидроксида натрия, поддерживая температуру в пределах 60 – 70 oС. Выделяющийся водород сбрасывают в атмосферу через трубу через огнепреградитель. После прекращения выделения водорода массу охлаждают, аппарат вновь продувают азотом, катализатор отфильтровывают на нутч фильтре, промывают водой до нейтральной реакции, следя за тем, чтобы над слоем катализатора оставался слой жидкости. Полученный катализатор помещают в закрытый приемник, где он хранится под слоем воды или спирта. Расход катализатора составляет около 5 % на массу субстрата восстановления. НР может быть использован повторно, если его активность не снижается. Показателем активности является пирофорность (воспламенение фильтровальной бумажки с нанесенным катализатором после его высыхания). При недостаточной активности никель вновь суспендируют в щелочи. Применяют также и палладиевые катализаторы. Дихлорид палладия сорбируют на угле или сульфате бария. Соль палладия в процессе восстановления водородом превращается в палладий. Отработанный катализатор необходимо переработать с извлечением драгоценного металла, каким является палладий. Аналогично готовят катализаторы, содержащие никель или кобальт, сорбированные на оксиде алюминия или силикагеле. Мелкодисперсные медный и кобальтовый катализаторы получают восстановлением соответствующих оксидов при 200 – 400 oС. Платину для проведения процессов гидрирования обычно не применяют. Ее использование эффективно при проведении процессов окисления, а для восстановления водородом есть более дешевые катализаторы. Гидрирование на катализаторе Адамса (КА, платиновой черни) проводится при более низких температурах и давлении, чем на НР. Готовят КА нагреванием при температуре 500 – 520 oС (NH4)2PtCl6 и NaNO3, образующийся PtO2 тщательно промывают дистиллированной водой от оставшихся неразложившихся солей. В процессе гидрирования диоксид платины превращается в мелкодисперсную платину. Субстраты восстановления не должны содержать серы и галогенов, а также ионов мышьяка, свинца и железа, которые отравляют НР и другие катализаторы.
Электрохимическое восстановление. Экологически чистым является электрохимическое восстановление. Для каждого соединения необходим подбор электродов и плотности тока. Недостатком этого метода является то, что для каждого процесса необходимо конструировать нестандартную аппаратуру.
Таким образом, выработать общие рекомендации для выбора метода получения конкретного соединения очень трудно. Поэтому в данном разделе представлен ряд синтезов соединений с использованием различных методов и реагентов. В первую очередь рассмотрены способы каталитического гидрирования.
Дата добавления: 2015-09-04; просмотров: 121 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Техника безопасности, экология | | | Восстановление кратных С-С связей |