
Читайте также:
|
Ранее уже рассматривался процесс превращения солей диазония в фенолы, но в качестве побочного процесса при диазотировании. Эта реакция может быть использована и как основной процесс.
Ar-N2+X- + H2O = [Ar+] X- + N2 = ArOH + HX + N2
Лимитирующей стадией является образование арильного карбокатиона, скорость этой реакции ниже скорости азосочетания. Но азосочетание является основно-каталитической реакцией, поэтому при получении фенолов из солей диазония используют растворы серной кислоты относительно высокой концентрации для того, чтобы предотвратить реакцию азосочетания. Однако серная кислота одновременно не должна быть и сульфирующим агентом, поэтому подбирают ее концентрацию так, чтобы превалировал основной процесс.
Рассмотрим эту реакцию на примере получения препарата фенилэфрин (мезатон). Диазотирование ведут в 16 – 17 % серной кислоте при температуре 8 – 14 oС, диазораствор медленно приливают к серной кислоте при 80 – 98 oС. Наряду с диазотированием происходит нитрозирование метиламиногруппы, однако при нагревании в серной кислоте нитрозогруппа удаляется. Серную кислоту связывают в виде гипса с помощью извести. Раствор основания мезатона очищают от примеси азосоединений активированным углем и переводят в гидрохлорид.

Еще одним технически важным процессом является превращение солей диазония в галогенопроизводные (реакции Зандмейера и Шимана):
ArN2+ X - + Cu2X2 = ArX + N2 + Cu2X2 X = Cl, Br, SCN, CN
ArN2+ BF4- = ArF + BF3 (реакция Шимана)
Механизм реакции Зандмейера был предметом многочисленных дискуссий. Общепринятой точкой зрения является то, что соли одновалентной меди в процессе реакции меняют свою валентность в реакционной клетке. Так при замене диазониевой группы на хлор образуется хлорная медь, свободный азот и арильный радикал, который затем реагирует с хлорной медью, давая хлороарил и однохлористую медь. Нельзя исключить и вариант с циклическим переносом заряда. Как видно из приведенной схемы, соль меди является катализатором процесса и в том случае, если она не связывается продуктом реакции, ее можно брать 0,1 моля. В зависимости от строения продуктов и реакционной способности соли диазония на 1 моль соли диазония используют от 0,1 до 1 моля соли меди.

Скорость реакции Зандмейера существенно выше скорости разложения по механизму SN1 и обычно выше скорости азосочетания. Реакция региоселективна, выход высокий и практически отсутствуют побочные продукты. При использовании продуктов в медицинской промышленности это является большим преимуществом по сравнению с галогенированием.
Так, технический 2,4-дихлортолуол, конечно же, получают хлорированием толуола. Однако его нельзя использовать в качестве промежуточного продукта при синтезе аминазина из-за содержащихся в нем даже в незначительном количестве примесей изомерного характера. Синтез 2,4-дихлор-толуола осуществляют из 2,4-толуилендиамина. Следует отметить техническую особенность: реакцию ведут в одном аппарате. Растворяют толуилендиамин в соляной кислоте, добавляют однохлористую медь и при 70 oС медленно прибавляют раствор нитрита натрия. Образующееся диазосоединение вступает не в реакцию сочетания с непрореагировавшим амином, а в реакцию Зандмейера! Соль меди из раствора превращают в медный порошок с помощью чугунных стружек для дальнейшего использования. Это позволяет не только экономить ценный металл, но и улучшает состав стока, т. к. хлорное железо переводят в оксид железа, который также можно использовать.
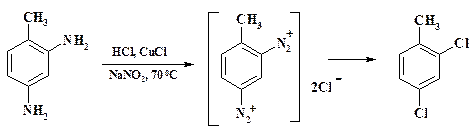
Получение иодпроизводных идет без участия катализатора. При синтезе препарата этиотраст разложение соли диазония ведут в иодистоводородной кислоте, которая частично превращается в элементарный йод, окрашивающий препарат, что несовместимо с требованиями Фармакопеи. Для удаления следов иода целевой продукт промывают раствором сульфита натрия, а затем содой.
I2 + Na2SO3 + H2O = NaI + HI + NaHSO4
При получении трийодтиронина (лиотреонина) проводят замену двух диазониевых групп на иод, т. к. прямое иодирование невозможно:

Диазотирование диаминопроизводного ведут в нитрозилсерной кислоте и полученный раствор соли диазония приливают к раствору иодистого натрия и иода. Целевой продукт экстрагируют хлороформом, раствор промывают сульфитом натрия.
Синтез производных фторбензола с помощью термического разложения тетрафторборатов диазония подробно рассмотрено в разделе 2.3.
Меньшее техническое значение имеет реакция дедиазотирования. При синтезе 3-нитротолуола, образующегося при прямом нитровании толуола в незначительных количествах, используют многостадийный процесс. При нитровании ацетилтолуидина образуется только один изомер, т. к. п -поло-жение занято, а ацетамидная группа является более сильным электронодонорным заместителем, чем метильная. Затем удаляют ацетильную защиту и диазотируют.

Замену диазониевой группы на водород осуществляют нагреванием в спирте. Таким образом, аминогруппа может выступать в роли защитной группировки, т. е. она вводится для направления реакции замещения в нужное положение и в дальнейшем удаляется. Если соль диазония использовать в реакции Зандмейера, то получается малодоступный 4-хлор-3-нитротолуол. Выход этого соединения при нитровании п -хлортолуола невысок и разделение изомеров является сложной технической задачей.
Замена диазогруппы на меркаптогруппу либо дисульфидную используется при получении красителя тиоиндиго – о- диазобензойная кислота реагирует с дисульфидом натрия, образуя соответствующий дисульфид.
Дата добавления: 2015-09-04; просмотров: 359 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Восстановление диазосоединений | | | Техника безопасности, экология |