
Читайте также:
|
8. 10. 2007
Лабораторная работа № 2
Приготовление и стандартизация рабочего раствора
азотной кислоты
Цель работы – приготовить 0,1 н. раствор HNO3 путем разбавления концентрированного раствора и установить его точную концентрацию.
Сущность работы. Точную концентрацию раствора HNO3 устанавливают по результатам титрования стандарта Na2CO3. При титровании с метиловым оранжевым протекает реакция
Na2CO3 + 2HNO3 → CO2↑ + H2O + 2NaNO3
Фактор эквивалентности Na2CO3 равен  .
.
Приборы и посуда: технические и аналитические весы; мерные цилиндры (20 и 50 мл); бюретка, пипетка Мора (10,0 мл); мерная колба (100,0 мл); конические колбы для титрования; денсиметр.
Реактивы: концентрированный раствор HNO3; Na2CO3 (х. ч.); индикатор – метиловый оранжевый.
Экспериментальные данные.
1. Приготовление рабочего раствора HNO3.
С помощью денсиметра измерили плотность концентрированного раствора HNO3: ρ = 1,095 г/см3. По данным справочника, этой плотности соответствует концентрация 2, 913 моль/л.
Рассчитаем объем концентрированной HNO3, необходимый для приготовления 500 мл 0,1 н. HNO3:
 .
.
В цилиндр объемом 500 мл прилили немного дистиллированной воды (≈100 мл), внесли рассчитанный объем концентрированной HNO3 (17 мл отмерили цилиндром) и довели объем раствора до 500 мл дистиллированной водой.
2. Стандартизация раствора HNO3.
Расчет навески Na2CO3:
m (Na2CO3) = C ( Na2CO3) · V (Na2CO3) · M(
Na2CO3) · V (Na2CO3) · M( Na2CO3);
Na2CO3);
m = 0,1 · 0,1 · 52,995 = 0,5300 г.
Результаты взвешивания.
Масса пустого тигля на технических весах m = 24,5 г.
Масса тигля с Na2CO3 на технических весах m = 25,1 г.
Масса тигля с Na2CO3 на аналитических весах m = 25,1052 г.
Навеска перенесена в мерную колбу вместимостью 100,0 мл.
Масса тигля с остатками Na2CO3 на аналитических весах m = 24,5648 г.
Масса взятой навески Na2CO3 m = 0,5404 г.
Расчет молярной концентрации эквивалента раствора Na2CO3:
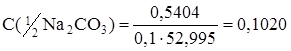 моль/л.
моль/л.
Результаты титрования.
V 1 = 10,3 мл; V 2 = 10,2 мл; V 3 = 10,3 мл.
Средний объем раствора HNO3:
 мл.
мл.
Расчеты определения.
Расчет молярной концентрации эквивалента раствора HNO3:
 моль/л.
моль/л.
15. 10. 2007
Лабораторная работа № 4
Определение Na2CO3 в растворе
Цель работы – определить массу Na2CO3 в растворе.
Сущность работы. На кривой титрования Na2CO3 наблюдается два скачка. Первый скачок соответствует уравнению
Na2СО3 + НNO3 = NaНСО3 + NaNO3
и отвечает переходу окраски фенолфталеина. Фактор эквивалентности Na2СО3 в этой реакции равен 1.
Второй скачок на кривой титрования Na2СО3 раствором НNO3 соответствует уравнению
NaHСО3 + НNO3 = Н2O + СО2 + NaNO3
и отвечает переходу окраски метилового оранжевого. Фактор эквивалентности Na2СО3 в этом случае равен  .
.
Реактивы: стандартный раствор НNO3, индикаторы – фенолфталеин и метиловый оранжевый.
Посуда: мерная колба (100,0 мл); пипетка Мора (10,0 мл); бюретка; конические колбы для титрования.
Экспериментальные данные.
1. Результаты титрования с фенолфталеином:
V 1 = 8,3 мл; V 2 = 8,2 мл; V 3 = 8,3 мл.
Средний объем раствора HNO3, пошедший на титрование пробы с фенолфталеином:
 мл.
мл.
Расчеты определения.
Расчет молярной концентрации эквивалента раствора Na2СО3 по результатам титрования с фенолфталеином:
 моль/л.
моль/л.
Расчет массы Na2CO3:
m (Na2CO3) = 0,08214 · 0,1 · 105,989 · 1 = 0,8706 г.
2. Результаты титрования с метиловым оранжевым:
V 1 = 16,6 мл; V 2 = 16,6 мл; V 3 = 16,5 мл.
Средний объем раствора HNO3, пошедший на титрование пробы с с метиловым оранжевым:
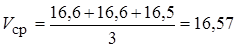 мл.
мл.
Расчеты определения.
Расчет молярной концентрации эквивалента раствора Na2СО3 по результатам титрования с метиловым оранжевым:
 моль/л.
моль/л.
Расчет массы Na2СО3:
m (Na2CO3) = 0,1646 · 0,1 · 105,989 ·  = 0,8723 г.
= 0,8723 г.
Истинный результат:
m (Na2CO3) = 0,8716 г.
Погрешность определений:

СОДЕРЖАНИЕ
| Предисловие | |
| 1. Организация лабораторных занятий на кафедре аналитической химии | |
| 1.1. Требования безопасности при выполнении лабораторных работ | |
| 1.2. Первая помощь при несчастных случаях | |
| 1.3. Организация лабораторных занятий | |
| 2. Гравиметрические методы анализа | |
| 2.1. Основные положения | |
| 2.2. Техника выполнения основных операций | |
| 2.3. Практические работы | |
| 2.4. Типовые расчеты в гравиметрии | |
| 2.4.1. Примеры решения типовых задач | |
| 2.4.2. Индивидуальные задания для самоподготовки | |
| 2.5. План коллоквиума «Гравиметрические методы анализа» | |
| 3. Титриметрические методы анализа | |
| 3.1. Основные положения | |
| 3.2. Техника выполнения основных операций | |
| 3.2.1. Мерная химическая посуда | |
| 3.2.2. Приготовление стандартных растворов | |
| 3.2.3. Взятие точной навески | |
| 3.2.4. Титрование | |
| 4. Метод кислотно-основного титрования (метод нейтрализации | |
| 4.1. Основные положения | |
| 4.2. Практические работы | |
| 4.3. Типовые расчеты в кислотно-основном титровании | |
| 4.3.1. Примеры решения типовых задач | |
| 4.3.2. Индивидуальные задания для самоподготовки | |
| 4.4. План коллоквиума «Титриметрические методы анализа. Метод кислотно-основного титрования» | |
| 5. Окислительно-восстановительное титрование | |
| 5.1. Основные положения | |
| 5.2. Перманганатометрия | |
| 5.3. Иодометрия | |
| 5.4. Практические работы | |
| 5.5. Индивидуальные задания для самоподготовки по методам окислительно-восстановительного титрования | |
| 5.5.1. Перманганатометрия | |
| 5.5.2. Иодометрия | |
| 6. Комплексонометрическое титрование | |
| 6.1. Основные положения | |
| 6.2. Практические работы | |
| 6.3. Индивидуальные задания для самоподготовки по методу комплексонометрического титрования | |
| 6.4. План коллоквиума «Метод окислительно-восстановительного титрования. Комплексонометрия» | |
| 7. Примеры составления отчетов о выполненных лабораторных работах | |
| 7.1. Гравиметрические методы анализа | |
| 7.2. Титриметрические методы анализа | |
| Содержание |
Учебное издание
Дата добавления: 2015-08-10; просмотров: 58 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гравиметричекие методы анализа | | | ХИМИЧЕСКИЕ МЕТОДЫ |