
Читайте также:
|
02.10.2007
Лабораторная работа № 1
Определение содержания железа (III) в растворе
Цель работы – определить массу железа (III) или соли Fe2(SO4)3 · 9H2O (г) в пробе.
Сущность работы. В основе определения лежит реакция осаждения железа (III) раствором NH4OH:
Fe3+ + 3NH4OH®Fe(OH)3¯ + 3NH4+
В процессе прокаливания при 800–900ºС осаждаемая форма Fe(ОН)3 переходит в гравиметрическую форму Fe2О3:
2Fe(ОН)3 = Fe2О3 + 3Н2О ↑
Гравиметрический фактор Fe (III) равен
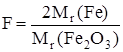 = 0,6994.
= 0,6994.
Приборы, посуда: технические и аналитические весы, электрическая плитка, муфельная печь, стакан, стеклянная палочка с резиновым наконечником, конические колбы, штатив с кольцом, воронка, мерный цилиндр, беззольный фильтр «белая лента».
Реактивы: 10%-ный раствор NH4OH, 2%-ный раствор NH4NO3, 2 н. раствор HNO3, 2 н. раствор BaCl2.
Ход выполнения работы.
Получили стакан № 28 с анализируемым раствором. К содержимому стакана добавили цилиндром 2 мл 2 н. HNO3. После нагревания раствора на электроплитке, провели осаждение раствором NH4OH, прибавляя его по каплям до образования бурого осадка и появления явного запаха аммиака. Затем добавили цилиндром 60 мл горячей дистиллированной воды. После отстаивания проверили полноту осаждения железа (III), добавляя несколько капель осадителя. Далее провели фильтрование осадка методом декантации. Осадок промыли горячим раствором NH4NO3 до полного удаления ионов SO42–. Фильтр с промытым осадком перенесли в пронумерованный тигель. Номер тигля – № 234. Фильтр осторожно обуглили, озолили и прокалили при температуре 800–900ºС до постоянной массы.
Результаты взвешивания.
Масса тигля с веществом после 1-го прокаливания на технических весах m = 24,3 г; на аналитических весах m = 24,3245 г.
Масса тигля с веществом после 2-го прокаливания на аналитических весах m = 24,3135 г.
Масса тигля с веществом после 3-го прокаливания на аналитических весах m = 24,3133 г, т. е. достигнута постоянная масса.
Осадок высыпали из тигля и взвесили пустой тигель:
m (пустого тигля) = 24,0992 г.
Масса полученной гравиметрической формы равна:
m (Fe2О3) = 0,2141 г.
Расчеты определения.
Массу железа (III) рассчитывают:
m (Fe3+) = 0,6994 · 0,1141 = 0,1497 г,
m (Fe2(SO4)3 · 9 H2O) = 1,5065 г.
Истинный результат:
m (Fe3+) = 0,1499 г.
Погрешность определений:
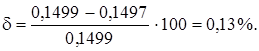
Дата добавления: 2015-08-10; просмотров: 53 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Индивидуальные задания для самоподготовки по методу комплексонометрического титрования | | | Титриметрические методы анализа |