
|
Читайте также: |
F2 + H2O → 2HF + O
2O → O2 3O → O3 O2 + O → O3
H2O + O → H2O2
F2 + O → F2O (OF2)
O+2F2– tпл = -223,8º С, tкип = -144,8º С F2O tпл = -163º С, tкип = -57º С.
2F2 + 2NaOH → 2NaF + H2O + F2O
4HI + OF2 = 2I2 + H2O +2НF
NaOH + OF2 = NaF + H2O + O2
:
| Валентное состояние | Фтор | Хлор | Бром | Иод | ||||
| оксид | кис-та | оксид | кис-та | оксид | кис-та | оксид | кис-та | |
| F2O | HFO | Cl2O | HOCl | Br2O | HOBr | – | HOI | |
| F2O2 | – | – | – | – | – | – | – | |
| – | – | – | HClO2 | – | – | – | – | |
| – | – | ClO2 | – | BrO2 | – | – | – | |
| – | – | – | HCl3 | – | HВrO3 | I2O2 | HIO3 | |
| – | – | Cl2O6 | – | BrO3 | – | – | – | |
| – | – | Cl2O7 | HClO4 | – | HВrO4 | – | HIO4 H5IO6 |
(HOF) впервые выделили в свободном состоянии М. Стаднер и И. Эппельман в 1971 г.
Конденсируется при -187º С, при повышении температуры (около -117º С) превращается в бесцветную жидкость, которая кипит в пределах от -50º С до -79º С.
HOF + H2O → HF + H2O2
Cl2 + H2O = HCl + HClO
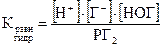
Cl2 + H2O ⇄ H+ + Cl– + HOCl
КpCl2 = 4·10–7, КpBr2 = 7·10–9, КpI2 = 2·10–13.
Hg + 2HCl + 2HClO → HgCl2 + 2HClO + H2O
HClO = HCl + O
HFO → HClO → HbrO → HIO Kд HOCl = 2·10-8, Kд HOBr = 2·10-9,
Kд HOI = 1·10-11.
2KOH + Cl2 = KCl + KClO + H2O
| Кислоты | Соли |
| HCl | KCl |
| Хлорноватистая | гирохлориты |
| HbrO | NaBrO |
| Бромноватистая | гипобромиты |
| HIO | NaIO |
| Иодноватистая | гипоиодиты |
KCl + KClO + H2O
Cl2 + 2KOH = KOCl + KCl + H2O (жавелевая вода)
NaCl + NaClO + H2O
CaCl2 + Ca(OH)2 + Ca(OCl)2.
2Ca(OH)2 + 2Cl2 = Ca(OCl)2 + CaCl2 + 2H2O
Дата добавления: 2015-07-21; просмотров: 40 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Галогеноводороды | | | Хлорная известь |