
L4 4L2 5PC(4/mmm)
49. Яким термічним ефектом (ендо- чи екзоефектом) супроводжується утворення кристалічної структури кераміки? Пояснити чому.
Екзо.Так як це процес утворення структур. Тому при утворенні структури енергія виділяється.
50. В чому різниця між лініями солідуса і ліквідуса? Привести приклад, показати па діаграмі.
Солидус - кривая, которая показывает для каждой температуры состав твёрдой фазы, которая может находиться в равновесии с жидкой.
Ликвидус - на фазовых диаграммах линия полного плавления твёрдых фаз  acb – ликвидус
acb – ликвидус
adb - солидус
51. Які вимоги пред'являються до керамічних матеріалів, які застосовуються при виробництві керамічних конденсаторі в? Пояснити.
Низькі діелектричні втрати, висока діелектрична проникність, термостабільність.
52. Що таке «внутрішня періодичність» рідкісноземельних елементів? Пояснити.
53. При яких умовах хімічна взаємодія не буде протікати спонтанно в усьому температурному інтервалі? Привести приклад.
DG=DH-TDS
при DH>0,DS<0. Тоді DG>0 і реакції не будуть протікати спонтанно в усьому температурному інтервалі
О2+N2=NO2
54. Диференціальні рівняння для ізоентропійного- ізобарного процесу. Вивести.
dH=TdS+Vdp
dz=H Mdx+Ndy=(dz/dx)ydX+(dz/dy)xdY
z=H M=T x=S N=V y=P
(dT/dp)s=(d^2H/dSdP)x,y
(dV/ds)t=(d^2H/dSdP)x,y
(dT/dp)s=(dV/dS)t
55. Як розрахувати зміну ентропії для випадку ізотермічного розширення ідеального газу?
DS-? T=const
dU=¶Q+¶W=0, ¶Q=-¶W=pdV
PV=RTÞp=(RT)/V, ¶W=(-(RT)/V)dV
¶Q=((RT)/V)dV
dS=dQ/T=(RT/TV)dV=>dS=(R/V)dV
DS=Rln(V2/V1)
56. Що таке гомеополярний і гетерополярний зв'язок? Привести приклади.
Гомеополярний зв’язок – це ковалентний зв’язок між однаковими атомами, при якому спарені електрони рівновіддалені від центрів атомів.
Гетерополярний зв’язок – ковалентний зв’язок, що відбувається між різними атомами, при йому електронна пара зміщується до одного із атомів.
H:Cl-гетеро H:H-гомо
57. Які елементи симетрії описують кінцеві операції симетрії 1 роду? Приклади.
Площина і центр симетрії, осі симетрії 1,2,3,4,6 порядків і інверсійні осі 3,4,6 порядків.
_
58. Яке число вузлів в об'ємноцентрованій і гранецентрованій гратці Браве? Представити на рисунку.
Об’ємоцентрована: 9 вузлів (припадає 2 атоми на елемент гратки)
 8*1/8+1=2
8*1/8+1=2
Гранецентрована: 14 вузлів (припадає 4 атоми на елемент гратки)
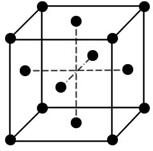 1/8*8+6*1/2=4
1/8*8+6*1/2=4
59. Частки якого мінімального розміру можна досліджувати з допомогою оптичного і електронного мікроскопу? Показати на схемі.
оптичний бачить до 0,4-0,7 мкм
електронний використовує потік електронів

60. Як визначити хімічний склад і процентний вміст фази, яка відповідає точці на діаграмі двохкомпонентної системи простого евтектичного вигляду? Правило важеля.

Правило важеля: 1)Проводиться лінія паралельно осі абсцис через т1 Кільце твердої фази yq/yB*100% рідкої фази qB/yB*100%
61. Що представляють собою домени в сегнетоелектриках?
Домен-це частина матеріалу в якій напрям поляризації має один напрямок.
62. Як зв’язана розповсюдженість елементів в природі з їх порядковим номером? Привести виключення.
Чим більший порядковий номер елемента-тим менше він розповсюджений в природі, також можна підмітити що парних(за порядковим номером) більше ніж непарних. Виключенням є Алюміній.
63. При яких умовах хімічна взаємодія буде протікати спонтанно в усьому температурному інтервалі? Пояснити, привести приклад.
DG=DH-TDS
DH<0, DS>0 то DG<0 а отже Спонтанна реакція протікає.
Пріклад: H2O2=H2O+O2
64. Диференціальні рівняння для ізотермічного-ізохорного процесу. Вивести.
dF=-SdT-pdV
z=F M=-S N=-P x=T y=V
S=-(dF/dT)v P=(-dF/dV)t
(dS/dV)t=(dF^2/dVdT)tv
(dP/dT)v=(dF^2/dVdT)tv
(dS/dV)t=(dP/dT)v
65. Як розрахувати зміну ентропії чистої речовини при зміні температури?
DS-? V=const
Cv=((¶Qv)/T), dQv=CvdT
dS=((dQv)/T)=(CvdT)/T, DS=Cvln(T2/T1).
66. Чому молекули мають певну форму? Пояснити на прикладі H2O і NH3.
Геометрична структура молекули визначається рівноважним розташуванням атомних ядер. Якщо при зближенні атомів утворюється хімічний зв'язок, то атоми сильно притягаються один до одного (слабке притягання спостерігається і без утворення хімічного зв'язку); при подальшому зближенні починають діяти електростатичні сили відштовхування атомних ядер. Перепоною до сильного зближення атомів є також неможливість суміщення їх внутрішніх електронних оболонок. Цим і пояснюється певна форма молекул. Також на форму молекули впливає наявність гібридизації її енергетичних рівнів.
_
67. Які елемент симетрії поєднує поворотну вісь і одночасне відображення в центрі симетрії? Привести приклад.
Інверсійна вісь симетрії включає в себе 2 дії: дію звичайної осі+відбитття через центр.
68. Які поєднання елементів симетрії містить дзеркально-поворотна вісь симетрії?
Дзеркальна поворотна вісь симетрії включає поворот навколо осі і відбивання в площині симетрії.
_
69. Принцип роботи оптичного мікроскопу. Привести схему і пояснити роботу.
Дослідження дрібнодисперсійних частинок.Для цього зразок необхідно готувати певним чином.Його необхідно поміщати в рідину.Виходячи з цього коефіцієнт опромінення води і зразка повинні бути схожими.
Без аналізатора можна побачити розмір і форму часток.
З аналізатором можна визначити, що матеріал анізотропний чи ізотропний.
Схема: Окуляр-Аналізатор-Лінза-Зразок-Поляризатор-Джерело світла.
70. В чому відмінності сполук, які розтоплюються конгруентно чи інконгруентно? Показати на прикладі діаграм.
Сполуки що утворюються конгуентно-іде до плавн.стану, не змінюючи хім.складу. (АВт->р)
Інконгуентно-зміна хім.складу перед розплавом (АВ->Ат+р->р)
71. Як змінюється реакційна здатність елементів І-ІІІ груп і чому?
Реакційна здатність елементів зменшується від 1 до 3 групи, оскільки один електрон легше відірвати ніж 2 чи 3.
72. Як зв'язана розповсюдженість елементів в природі з їх порядковим номером? Привести виключення.
Чим більший порядковий номер елемента-тим менше він розповсюджений в природі, також можна підмітити що парних(за порядковим номером) більше ніж непарних. Виключенням є Алюміній.
73. При яких умовах хімічна взаємодія буде протікати спонтанно при високій температурі і не буде про тікати при низькій температурі? Привести приклади.
DG=DH-TDS
DH<0, DS>0 то DG<0 а отже Спонтанна реакція протікає.
Пріклад: H2O2=H2O+O2
74. Диференціальні рівняння для ізотермічного-ізобарного процесу. Вивести.
dП=-SdT-VdP
z=G M=-S N=V x=T y=P
S=-(dG/dT)p V=(dG/dP)t
-(dS/dP)t=(dG^2/dPdT)pv
(dV/dT)p=(dG^2/dPdT)pv
-(dS/dP)t=(dV/dT)v
75. Чому неможливо досягти температури абсолютного нуля?
При зменшенні температури зменшується також інтенсивність коливання частинок у вузлах градки. За цих умов час релаксації зростає
Для досягнення темп. Абсолютного нуля, час релаксації має прямувати до нескінченності, тобто це не є можливим!
(неможливо тому що Ентропія прямує ло 0 при наближенні до 0 градусів
при охолодженні тіла його ентропія падає а вссі процеси в природі йдуть самочинно а отже ентропія має рости тобто тіло не може мати температуру абсолютного нуля)
76. Чому утворюються молекули? Чому два атоми водню з'єднуються з утворенням молекули водню H2, тоді як два атоми гелію не з'єднуються?
Атоми об'єднуються в молекулі в більшості випадків за допомогою хімічних зв'язків. Як правило, такий зв'язок утворюється парами електронів, які перебувають у спільному володінні двох атомів, утворюючи спільну електронну хмару, форма якої описується типом гібридизації.
Тому що в атомі гелію повністю заповнений зовнішній енергетичний рівень (1s2), а в атомі водню є лише один із двох можливих електронів на зовнішньому рівні (1s1).
77. Якими елементами симетрії описується зовнішня симетрія кристалів? Привести приклади.
Зовнішня симетрія кристалу описується 10 елементами симетрії:
-осі симетрії (1,2,3,4,6)
-площина симетрії (m)
-центр симетрії (С)
-інверсійні осі симетрії (3,4,6) (все цыфры подчеркнуть нужно сверху!)
78. В матеріалах яких класів симетрії не можуть виникати п'єзоелектричні властивості, чому?
П’єзоелектричні властивості виникають тільки там де немає центру симетрії. так як вони мають полярні напрямки.
79. Принцип роботи металографічного мікроскопу. Привести схему і пояснити роботу.
Світло проходить через поляризатор відбивається від зразка фокусується лінзою проходить через аналізатор і подається на окуляри.(Працює тільки з непрозорими матеріалами з добрим відбиттям, тобто металами)
Схема: Світло-Поляризатор-Зразок-Лінза-Аналізатор-Окуляри
80. При охолодженні яких систем (які розтоплюються конгруентно чи інконгруентно) можна легко отримати скло? Показати на діаграмі.
При розтопленні інкогруентних.
81. Як змінюється ступінь гідратації лужних металів? Чому?
Із збільшенням іонного радіусу збільшується ступінь гідратациї тобто у Li-він найменший у Cs-найбільший.
82. Чому в ряду Cr-Mo-W властивості молібдену значно ближчі до вольфраму ніж до хрому? Пояснити на прикладі заповнення їх енергетичних рівнів.
тому що із збільшенням номеру в таблиці радіуси мало відрізняються один від одного за рахунок невеликої різниці орбітальних радіусів
Властивості молібдену близькі до вольфраму із за ефекту лантаноїдного зжимання.
Cr=…3d54s1
Mo=…4d65s1
W=…5d46s2
_
83. При яких умовах хімічна взаємодія буде протікати спонтанно при низькій температурі і не буде протікати при високій температурі?
DG=DH-TDS
DH<0, DS>0 спонтанно при низькій
84. Диференціальні рівняння для ізоентропійного-ізохорного процесу. Вивести.
H=U+PV
S=const
V=const
dU=dH-Vdp=SdT
dU=TdS-pdV T=(du/ds )v P=-(du/dv) s => (du/ds )v =-(du/dv) s
85. Як реалізувати метод адіабатичного розмагнічування? Пояснити словами, привести рисунок.

Адіабатична-абсолютно ізольована система.ніякого обміну енергією
0)Хаос магн.моментів
1)НÝ вплив сильного магнітного поля ÝÝÝ
2)НÏ (прибираємо магнітне поле і система бере енергію сама у себе)
3)НÝ... повторюємо ці кроки n-раз
Для того щоб зменшити ентропію ми подаємо магнітне поле на наш об’єкт, потім прибираємо, і щоб відновити рівновагу об’єкт зменшує температуру Потім знову діемо магнітним полем і так кожного разу
86. Чому швидкість ряду хімічних реакцій збільшується під дією опромінення? Привести приклади.
Тому що енергії кванта світла hn достатньо щоб розірвати зв’язок у деяких молекулах.
87. Який елемент симетрії утворюється при перетинанні парної осі симетрії і перпендикулярної їй площині? Привести приклад.
Центр симетрії утворюється при перетині парної осі симетрії та площини симетрії(в точці симетрії)
Також дане визначення називають “Теоремою співвідношення”
88. В чому особливість запису точкових класів сиетрії для кубічної сингонії? Пвивести приклад.
На другому місці буде знаходитися цифра 3, яка означає вісь 3-го порядку.
м3м
89. Описати технологічну схему виготовлення кераміки.
1)контроль виходних реагентів
2)розрахунок вих. Реагентів
3) підготовка реагентів (прокалення охолодження в екс…)
4)відбір реагентів 4а) термообробка 5) перший помел 6) сушка 7)термообробка 1 8) 2 помел 9)сушка 2 10) введення зв’язуючого 11) підготовка пресформи 12)формулювання заготовок виробу 13) спікання 2 14) тестування властивостей 15) механічна обробка.
90. В чому відмінності оптичного і металографічного мікроскопів? Привести схеми.
-структура(будова):
Оптичний:
(Джерело світла-поляризатор-зразок-лінза-аналізатор-окуляр)
Металографічний:
(Світло-поляризатор-зразок-лінза-аналізатор-окуляр)
-оптичний працює на просвіт, а металографічний на відбивання
-(зразок)матеріал, що розглядається: в Оптичному-мілкодисперсний порошок
в Металографічному-будь який (наприклад кераміка) з протравленною поверхнею(попередньо обробленою)
91. Чому елементи VI групи головної підгрупи мають змінну валентність? Пояснити.
Тому що електрон може переходити з рівня на рівень, на вільне місце(наприклад з 4s до 3d) тому що там є вільне місце
92. Як змінюється стабільність елементів VIII групи у вищих валентностях при переході від першої тріади до другої і третьої? Пояснити.
Стабільність зменшується із порядковим номером через те, що їх активність зменшується!
93. Як реалізувати метод адіабатичного розмагнічування? Пояснити словами, привести рисунок.

Адіабатична-абсолютно ізольована система.ніякого обміну енергією
0)Хаос магн.моментів
1)НÝ вплив сильного магнітного поля ÝÝÝ
2)НÏ (прибираємо магнітне поле і система бере енергію сама у себе)
3)НÝ... повторюємо ці кроки n-раз
Для того щоб зменшити ентропію ми подаємо магнітне поле на наш об’єкт, потім прибираємо, і щоб відновити рівновагу об’єкт зменшує температуру Потім знову діемо магнітним полем і так кожного разу
94. Диференціальні рівняння для ізоентропійно-ізобарного процесу. Вивести.
dH=TdS+Vdp
dz=H Mdx+Ndy=(dz/dx)ydX+(dz/dy)xdY
z=H M=T x=S N=V y=P
(dT/dp)s=(d^2H/dSdP)x,y
(dV/ds)t=(d^2H/dSdP)x,y
(dT/dp)s=(dV/dS)t
95. Як розрахувати абсолютне значення ентропії для перегрітого водяного пару? Привести приклад.
S=Cp ln (T2/T1)??????????????????????????
96. Як експериментально відрізнити реакції першого і другого порядку? Показати па графіках.
Реакції першого порядку: lg(а-х)=-кt/2.303 + lga
Реакції другого порядку: 1/а-х =1/а =кt.
Потрібно експериментальні дані представити як Реакції першого порядку і як Реакції другого порядку. По цим зплежностям можна відрізнити порядок реакції.
За графіком. Для реакцій першого порядку залежність логарифму концентрації від часу реакції має вигляд:

Для реакцій 2-го порядку залежність оберненої концентрації від часу реакції має вигляд:

97. Що таке точкова група симетрії? Привести приклади.
Симетрія буває внутрішня і зовнішня.
Основні складові(елементи груп симетрії):
-осі симетрії (1,2,3,4,6)
-площина симетрії (m)
-центр симетрії (С)
-інверсійна вісь симетрії (1, 2, 3, 4, 5, 6) (все цыфры подчеркнуть нужно сверху!)
-дзеркальна вісь симетрії
Постійно використовується 10 елементів симетрії:
(1,2,3,4,6,m,C, 3, 4, 6)
Наприклад: Залежно від класів і сингоній виділяється 32 точкових групи. Наприклад: 2/m (моноклинна-планальноаксіальний) L2PC
422 (тетрагональна-аксіальний) L44L2
98. Дати характеристику кристалографічним категоріям (вища, середня, нижча), сингоніям. Детально розписати.
До нижчої кристалографічної категорії належать триклинна, моноклинна і ромбічна сингонії. До середньої кристалографічної категорії належать тетрагональна, тригональна і гексагональна сингонії. До вищої кристалографічної категорії належить кубічна сингонія
У кристалографії існує 7 сингоній, що відносяться до нижчої середньої та вищої категорій симетрії залежно від параметрів:
НИЖЧА: -триклинна(найбільш несеметрична) а≠в≠с, α≠β≠γ
-моноклинна а≠в≠с, α=γ=90°≠β
-ромбічна а≠в≠с, α=β=γ=90°
СЕРЕДНЯ: -гексагональна а=в≠с, α=β=90° γ=120°
-тринональна???
-тетрагональна а=в≠с, α=β=γ=90°
ВИЩА: - кубічна а=в=с (а), α=β=γ=90°
99. Які переваги методу осадження з розчинів при синтезі порошків оксидних матеріалів? Привести приклад.
При осадженні з водних розчинів є моожливість підвищити хімічну однорідність матеріалів (на молекулярному рівні)
_
100. На яких фізичних явищах базується робота методів ЕПР і ЯМР? Яку інформацію про будову твердого тіла можна отримати з допомогою цих методів?
Спектральні методи працюють на різних частотах:
ЯМР-108Гц (Поворот магнітного ядерного моменту ядра
ЕПР-1010Гц (Поворот магнітного моменту спіна
Досліджується кристалічна структура!
101. Чому в ряду Cr-Mo-W властивості молібдену значно ближчі до вольфраму ніж до хрому? Привести їх електронну структуру.
тому що із збільшенням номеру в таблиці радіуси мало відрізняються один від одного за рахунок невеликої різниці орбітальних радіусів
Властивості молібдену близькі до вольфраму із за ефекту лантаноїдного зжимання
102. Як змінюється електропровідність елементів І-ІIІ груп і чому? Як змінюється реакційна здатність елементів І-ІІІ груп і чому?
В 1 групі електропровідність найбільша і поступово зменшується(в 4 групі вона мінімальна) за рахунок того, що в 1 групі елементи найлегше віддають електрон.
аналогічно до попереднього Реакційна здатність зменшується!
103. Що таке зворотній і незворотній процес?
Зворотній процес – це процес в якому реакція може проходити у обидва напрямки без додавання сторонніх речовин
Незворотній навпаки. Як приклад можна привести розклад радіоактивних речовин – це незворотній процес.
104. Диференціальні рівняння для ізотермічного-ізохорного процесу. Вивести.
dF=-SdT-pdV
z=F M=-S N=-P x=T y=V
S=-(dF/dT)v P=(-dF/dV)t
(dS/dV)t=(dF^2/dVdT)tv
(dP/dT)v=(dF^2/dVdT)tv
(dS/dV)t=(dP/dT)v
105. Як відрізняється величина ентропії речовини в твердому, рідкому та газоподібному стані? Пояснити.
Ентропія—величина безпорядку. Тому ентропія у твердому стані мінімальна. Sтв.<Sрід.<<Sгаз
106. В яких одиницях визначається константа швидкості реакції?
Для реакцій 1-го порядку [k] = 1/с
Для реакцій 2-го порядку [k] = л/(моль*с)
Для реакцій 3-го порядку [k] = л2/(моль2*с)
107. Що таке точкова група симетрії? Привести приклади.
Симетрія буває внутрішня і зовнішня.
Основні складові(елементи груп симетрії):
-осі симетрії (1,2,3,4,6)
-площина симетрії (m)
-центр симетрії (С)
-інверсійна вісь симетрії (1, 2, 3, 4, 5, 6) (все цыфры подчеркнуть нужно сверху!)
-дзеркальна вісь симетрії
Постійно використовується 10 елементів симетрії:
(1,2,3,4,6,m,C, 3, 4, 6)
Наприклад: Залежно від класів і сингоній виділяється 32 точкових групи. Наприклад: 2/m (моноклинна-планальноаксіальний) L2PC
422 (тетрагональна-аксіальний) L44L2
108. Дати характеристику кристалографічним категоріям (вища, середня, нижча), сингоніям. Детально розписати.
До нижчої кристалографічної категорії належать триклинна, моноклинна і ромбічна сингонії. До середньої кристалографічної категорії належать тетрагональна, тригональна і гексагональна сингонії. До вищої кристалографічної категорії належить кубічна сингонія.
У кристалографії існує 7 сингоній, що відносяться до нижчої середньої та вищої категорій симетрії залежно від параметрів:
НИЖЧА: -триклинна(найбільш несеметрична) а≠в≠с, α≠β≠γ
-моноклинна а≠в≠с, α=γ=90°≠β
-ромбічна а≠в≠с, α=β=γ=90°
СЕРЕДНЯ: -гексагональна а=в≠с, α=β=90° γ=120°
-тринональна???
-тетрагональна а=в≠с, α=β=γ=90°
ВИЩА: - кубічна а=в=с (а), α=β=γ=90°
109. Частки якого мінімального розміру можна досліджувати з допомогою оптичного і електронного мікроскопу? Показати на схемах.
оптичний бачить до 0,4-0,7 мкм
електронний використовує потік електронів

110. На яких фізичних явищах базуються спектральні методи (ЯМР, ЕПР, мікрохвильова спектроскопія, ІК спектроскопія, спектроскопія видимого випромінювання, УФ спектроскопія, рентгенівська спектроскопія)?
ЯМР-для повороту магн ядер
ЕПР- поворот спінів
мікрохвильова спектроскопія- обертальні переходи
ІК спектроскопія- інфрачервона- поворот молекул
спектроскопія видимого випромінювання, УФ спектроскопія- поворот молекул
рентгенівська спектроскопія-обумовлена переходами внутрішніх оболонок атомів
111. Елементи 3-4 груп. Особливості електронної будови рідкісноземельних елементів. Перехідні елементи; розповсюдження елементів в природі.
Рідкоземельні елементи-група з 17 елементів що включає Лантан Скандій Ітрій і лантаноїди
Всі ці елементи- метали сріблясто-білого кольору при тому всі мають подібні хім.властивості(характерна ступінь окиснення +3)
У ряду зі зростанням номеру іонний радіус зменшується! Спостерігається явище лантаноїдного стискання
радіус атомів і активність у цій групі зростає зверху вниз!
112. В чому суть «правила діагональної спорідненості», привести приклад.
Ве-Аl, B-Si елементи мають схожі властивості
113. Що таке корисна робота системи? Пояснити, привести формули.
¶W=pdw+dw(корисна робота системи відповідає за хімічну взаємодію речовин)
¶W=-¶U+TdS-PdV- визнач кор робота
114. Диференціальні рівняння для ізотермічного-ізобарного процесу. Вивести
dП=-SdT-VdP
z=G M=-S N=V x=T y=P
S=-(dG/dT)p V=(dG/dP)t
-(dS/dP)t=(dG^2/dPdT)pv
(dV/dT)p=(dG^2/dPdT)pv
-(dS/dP)t=(dV/dT)v
115. Чому дорівнює робота системи при ізохорно-ізотермічних процесах?
T=const V=const
dW=-dU+TdS U=F+TS=-dF
dW=-ΔF немех работа дор зменьшеню вільної енергії
116. Для реакції якого порядку час проходження її на 50% не залежить від початкової концентрації? Привести формулу.
Для реакцій 1-го порядку
117. Який елемент симетрії утворюється при перетинанні парної осі симетрії і перпендикулярної їй площини? Привести рисунок.
Центр симетрії утворюється при перетині парної осі симетрії та площини симетрії(в точці симетрії)
Також дане визначення називають “Теоремою співвідношення”
118. В чому особливість запису точкових класів симетрії для кубічної сингонії? Привести приклад.
На другому місці буде знаходитися цифра 3, яка означає вісь 3-го порядку.
м3м
119. Принцип роботи оптичного мікроскопу. Привести схему і пояснити роботу.
Дослідження дрібнодисперсійних частинок.Для цього зразок необхідно готувати певним чином.Його необхідно поміщати в рідину.Виходячи з цього коефіцієнт опромінення води і зразка повинні бути схожими.
Без аналізатора можна побачити розмір і форму часток.
З аналізатором можна визначити, що матеріал анізотропний чи ізотропний.
Схема: Окуляр-Аналізатор-Лінза-Зразок-Поляризатор-Джерело світла.
120. При яких умовах утворюються тверді розчини заміщення? Привести приклади.
Утв.при заміщенні ізольованих йонів в одинакових кристалографічних підгратках з однаковими степенями окиснення
Ba2+(1-x)Sr2+x)TiO3
121. Елементи 1-2 груп. Як змінюється електропровідність елементів 1-2 груп і чому?
1-група лужні LiNa- викор як аноди приелекртолізі, добавка до кондн. Сu,Ag,Au—різниця в хім. властивостях мала
Ел. 2-ої групи викор як матеріал для створення п’єзо і сегнето електриків
Електропров зменш від 1 до 2
Zn, Cd, Hg- у НП А2В4
Li 1s2 2s1 Be 1s2 2s2
122. Особливості електронної будови рідкісноземельних елементів. Привести приклад заповнення їх енергетичних рівнів.
Рідкоземельні елементи-група з 17 елементів що включає Лантан Скандій Ітрій і лантаноїди
Всі ці елементи- метали сріблясто-білого кольору при тому всі мають подібні хім.властивості(характерна ступінь окиснення +3)
У ряду зі зростанням номеру іонний радіус зменшується! Спостерігається явище лантаноїдного стискання
радіус атомів і активність у цій групі зростає зверху вниз!
123. Що таке стандартний стан? Привести приклади.
Стандартний стан елементу(простої речовини) в термодинаміці
298 К і тиск 1 атмосфера
приклад:Вуглець у вигляді графіту
Водень, азот, фтор(2-о атомний), газ при 1 атм
124. Диференціальні рівняння для ізоентропійно-ізохорного процесу. Вивести.
H=U+PV
S=const
V=const
dU=dH-Vdp=SdT
dU=TdS-pdV T=(du/ds )v P=-(du/dv) s => (du/ds )v =-(du/dv) s
125. В яких випадках хімічний процес є спонтанним при низькій температурі, а в яких випадках при високій? Привести приклади.
DG=DH-TDS
DH<0, DS<0(при низькій) H2+N2=NH3
DH>0, DS>0(при високій) N2+O4=2NO2
126. Що таке складний хімічний процес? Як визначається порядок реакції для складного процесу? Привести приклад.
Складний процес, який іде в кілька стадій. Порядок складного процесу визначається порядком стадії, яка має найменшу швидкість. Порядок реакції можна «визначити графічно, які будуються на основі експериментальних даних.
_
127. Якими елементами симетрії описується зовнішня симетрія кристалів? Привести приклад.
128. В матеріалах яких класів симетрії не можуть вимикати п'єзоелектричні властивості, чому?
П’єзоелектричні властивості виникають тільки там де немає центру симетрії. так як вони мають полярні напрямки.
129. Принцип роботи оптичного мікроскопу. Привести схему і пояснити роботу.
Дослідження дрібнодисперсійних частинок.Для цього зразок необхідно готувати певним чином.Його необхідно поміщати в рідину.Виходячи з цього коефіцієнт опромінення води і зразка повинні бути схожими.
Без аналізатора можна побачити розмір і форму часток.
З аналізатором можна визначити, що матеріал анізотропний чи ізотропний.
Схема: Окуляр-Аналізатор-Лінза-Зразок-Поляризатор-Джерело світла.
130. Чому тверді розчини заміщення переважно бувають при заміщенні в катіонних ґратках і рідко зустрічаються при заміщенні в аніонних ґратках? Пояснити.
ТР заміщення утворюються при заміщенні ізовалентних іонів в однакових кристалографічних градках
Необхідна умова: іонні радіуси відрізняються на ≤15 %
Умова виконується найчастіше в катіонних градках, значно рідше в аніонних(значна різниця радіусів)
Приклад:
(1-x)BaTiO3-xSrTiO3Þ(Ba2+(1-x)Sr2+x)TiO3
131. Чому властивості елементів ІV групи в ряду C - Pb змінюються від неметалічних (С) до металічних (Рb)? Привести заповнення їх енергетичних рівнів.
Така зміна властивостей спостерігається в усіх групах(зверху вниз-від неметалічних до металічних) С-основа кераміки, від С до Рв збільшується електропровідність
132. Як змінюється електронна структура і властивості елементів в ряду Ti – Zr - Hf? Пояснити як і чому?
Стабільність збільшується, мет.властивості збільшуються через радіус і збільшується електропровідність
133. Які параметри стану використовують в хімії для визначення стану системи? Привести приклади.
Дата добавления: 2015-07-25; просмотров: 104 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Чому дорівнює робота системи при ізобарно-ізоентропійному процесі? | | | DН, Т, DG, P, V, S |