
Читайте также:
|
dW’=-dU+TdS-pdV
dW’=-dU-pdV=-dH
W’= ΔH буде дорівнювати зменшенню ентальпії
14. Диференціальні рівняння для ізоентропійно-ізобарного процесу. Вивести.
dH=TdS+Vdp
dz=H Mdx+Ndy=(dz/dx)ydX+(dz/dy)xdY
z=H M=T x=S N=V y=P
(dT/dp)s=(d^2H/dSdP)x,y
(dV/ds)t=(d^2H/dSdP)x,y
(dT/dp)s=(dV/dS)t
15. В чому відмінність теплової енергії процесу, який протікає при постійному об'ємі і постійному тиску? В яких випадках вони рівні?
P=const ΔU=Qp-p(v1-v2)=U2-U1
Qp=U2-U1+p(V2-V2)=(U2+pV2)-(U1+pV1)=H2-H1 Qp=ΔH
V=const dU=dQ-pdV dU=dQv
ΔU=Qv ΔU=Qp-p(V2-V1)
Qp=Qv+ΔnRT, де Δn=[(c+d)-(a+b)] Qp=Qv коли (c+d)=(a+b)
16. Чому швидкість ряду хімічних реакцій збільшується під дією опромінення? Привести приклади.
Тому що енергії кванта світла hv(ню) достатньо щоб розірвати зв’язок у деяких молекулах.
H v hv(ню)
H-C-H+Cl-Cl = a) CH4+Cl->CH3+HCl
H b) CH3+Cl2->CH3Cl+Cl
17. Які символи відповідають площині, що відсікає на осях координат відрізки 4а, Зb, 2с?
1/4a:1/3b:1/2c=3 4 6 (346)
18. Які елементи симетрії поєднує гвинтова вісь симетрії?
Гвинтова вісь симетрії включає дві дії: поворот навколо осі на кут, що визначається порядком осі і зміщення вздовж осі на величину індекс / порядок осі.
19. Описати технологічну схему виготовлення кераміки.
1)контроль виходних реагентів
2)розрахунок вих. Реагентів
3) підготовка реагентів (прокалення охолодження в екс…)
4)відбір реагентів 4а) термообробка 5) перший помел 6) сушка 7)термообробка 1 8) 2 помел 9)сушка 2 10) введення зв’язуючого 11) підготовка пресформи 12)формулювання заготовок виробу 13) спікання 2 14) тестування властивостей 15) механічна обробка.
20. Дана фазова діаграма чистої речовини Р = f (Т). В якому випадку крива плавлення має від'ємний нахил, нульовий нахил, додатній нахил? Привести приклад.
ΔНпл=T; ΔV(dp/dT)пл.
ΔНпл>0 Ti>0
1) ΔV>0 (dp/dt)>0
2) ΔV<0 (dp/dt)<0
21. Які матеріали називаються сегнетоелектриками? Привести приклади.
Cегнетоелектрики – матеріал в яких виникає спонтанна поляризація в певному температурному інтервалі ВаТіО3
22. Чому хімічні властивості ніобію і танталу подібні? Пояснити на прикладі заповнення енергетичних рівнів.
Радіуси іонів ніобію і танталу близькі із зі ефекту лантаноїдного зжимання. Так як концентрація електронів більша на нижніх рівнях. На останньому рівні в них заповнена тільки s-орбіталі Тому їх властивості близькі.
23. Чому дорівнює робота системи при ізохорно-ізоентропійному процесах?
S=const V=const
dW’=-dU ΔW=-ΔU
дорівнює зменшенню внутрінньої енергії реакції
24. Диференціальні рівняння для ізотермічного-ізохорного процесу. Вивести.
dF=-SdT-pdV
z=F M=-S N=-P x=T y=V
S=-(dF/dT)v P=(-dF/dV)t
(dS/dV)t=(dF^2/dVdT)tv
(dP/dT)v=(dF^2/dVdT)tv
(dS/dV)t=(dP/dT)v
25. Що таке «скрита теплота» зміни стану? Привести приклад.
«Скрита теплота» це енергія, яка поглинається тілом без зміни температури тіла (^ наприклад, топлення леду, кипіння води).
26. Як експериментально відрізнити реакції першого і другого порядку? Показати графічно.
Реакції першого порядку: lg(а-х)=-кt/2.303 + lga
Реакції другого порядку: 1/а-х =1/а =кt.
Потрібно експериментальні дані представити як Реакції першого порядку і як Реакції другого порядку. По цим зплежностям можна відрізнити порядок реакції.
За графіком. Для реакцій першого порядку залежність логарифму концентрації від часу реакції має вигляд:

Для реакцій 2-го порядку залежність оберненої концентрації від часу реакції має вигляд:

27. Знайти символи площини, паралельної осям х і z і які відсікають 3 одиниці по осі у.
h:k:l=1/ ∞: 3/6: 1/ ∞ (030)
28. Граничні групи симетрії. Скільки їх, привести приклади.
Граничні групи симетрії, які містять осі безконечного порядку.
Осями безкінечного порядку описується симетрія зовнішніх полів і властивості матеріалу. Всього їх 7: ∞; ∞/m; ∞m; ∞2; ∞/∞; ∞/mm; ∞/∞m.
29. Які відмінності між монокристалом і керамікою? Пояснити.
Монкристал—кристалічна речовина складена з одного кристалу. Кераміка—заразок з тієюж хім. структурою яка складається з чисельних монокристалів.
30. В чому відмінність фази і числа компонентів? Привести приклад.
Фаза, наприклад, тверда, рідка чи газоподібна фаза (Н20). В гой же час в цій системі (трьохфазні) є тільки один компонент
P(кількість фаз)+F=C(кількість компонентів)+1(незначний тиск),2(значний тиск)
31. Які матеріали називаються п’єзоелектриками? Привести приклали.
Пєзоматеріали це клас матеріалів, які належать до нецентросемеиричних класів симетрії, в яких при прикладені механічних навантажень виникає електрична поляризація
32. Завдяки яким хімічним властивостям марганцю його часто використовують як важливу складову сплавів? Пояснити, привести приклад.
Марганець зав’язує кисень тим самим підвищує антикорозійну властивість матеріалу. FeMg+O2->….
33. Чому дорівнює робота системи при ізобарно-ізотермічних процесах?
T=const P=const
dW’=-dU+TdS-PdV=-ΔG G—термодинам пот Гібса
dW’=-ΔG робота системи дор зменш пот Гібса
34. Диференціальні рівняння для ізотермічно- ізобарного процесу. Вивести.
dП=-SdT-VdP
z=G M=-S N=V x=T y=P
S=-(dG/dT)p V=(dG/dP)t
-(dS/dP)t=(dG^2/dPdT)pv
(dV/dT)p=(dG^2/dPdT)pv
-(dS/dP)t=(dV/dT)v
35. Як з допомогою циклу Борна-Габера визначити енергію кристалічної комірки NaCl? Привести схему, привести вираз для розрахунку.
Енергія кристалічноїградки—це є енергія яка необхідна для одержання одного моля NaCl з газоподібного йому Na+ та газ Cl-
Na+(газ)+ Cl-(газ)= NaCl
Na+(тв)+1/2 Cl2(газ) –(-99ккал)------à NaCl <--
I I I
I (26ккал) à1/2(Cl+Cl)à(29ккал)à Cl-(-88ккал)I
à Na(газ)-------à Na+(газ) (117ккал)
-99=55+117-88+E2 E2=-183 ккал
36. Чому вуглець утворює в метані СН4 еквівалентні зв'язки? Привести електронну конфігурацію, рисунок.
С 1s2 2s2 2p2
C* 1s2 2s1 2p3
Через sp3-гібридизацію:

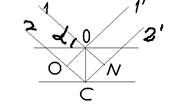
37. При яких умовах рентгенівські промені, які відбиваються від кристалографічних площин, підсилюють одне одного? Закон Вульфа-Брега.
Якщо промені будуть у спів фазі (1’;2’)
OC=d nl(лямда)=2dsin a(альфа)
38. Які елементи симетрії поєднує площина ковзаючого відбивання? Привести приклад.
Площина ковзаючого відбивання включає дві дії: відбивання в площині і зміщення на половину елементарної гратки вздовж площини: m = p + ½*a
_
39. Які переваги методу осадження з розчинів при синтезі порошків оксидних матеріалів? Привести приклад.
При осадженні з водних розчинів є моожливість підвищити хімічну однорідність матеріалів (на молекулярному рівні).
40. На діаграмах двохкомпонентної системи простого евтектичного вигляду які поля біваріантні, а які моноваріантні? Показати на діаграмі.

41. Що таке перехідні метали? Привести приклади.
Перехідні метали, це метали в яких іде заповнення передостаннього енергетичного рівн (залізо, кобальт, марганець,....). Ti 1s2 2s2 2p6 3s2 3p6 4s2 3d2
42. Які відомі застосування елементів нульової групи в техніці?
Елементи нульової групи використовуються в лампах розжарювання.
43. Чому дорівнює робота системи при ізохорно-ізотермічних процесах?
T=const V=const
dW=-dU+TdS U=F+TS=-dF
dW=-ΔF немех работа дор зменьшеню вільної енергії
44. Диференціальні рівняння для ізоентропійно-ізохорного процесу. Вивести.
H=U+PV
S=const
V=const
dU=dH-Vdp=SdT
dU=TdS-pdV T=(du/ds )v P=-(du/dv) s => (du/ds )v =-(du/dv) s
45. В чому суть принципу максимуму ентропії?
Кожному стану рівноваги відповідає певний максимум ентропії.
46. Чому и молекулі води 2ϭ-зв’язки О-Н утворюють кут відмінний від 900? Показати і пояснити.
Геометрія молекули води плоска

47. Що означають індекси Міллера? (наприклад, (001), (230),...). Показати на рисунку.
В кристалографії площини характеризують індексами Міллера. Індекс Міллера – це величина, яка обернена параметрам Вейса і приведена до цілих чисел. Індекс Міллера – це величина, які позначають скільки відрізків ми взяли на кожній з осях
(001)ділить площину z на 1 відрізок
48. Виходячи з принципу суперпозиції Кюрі показати, як впливає одноосна механічна розтягуюча сила на кристал m3m. Привести рисунок, точкові групи.
 m3mà3L4 4L3 6L2 9PC
m3mà3L4 4L3 6L2 9PC
Дата добавления: 2015-07-25; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Що таке відкрита, закрита і ізольована система? | | | Agrave;6/mmmà L6 6L2 7PC |