
СБОРНИК ЗАДАНИЙ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ К ЗАНЯТИЯМ ПО «ОБЩЕЙ И
НЕОРГАНИЧЕСКОЙ ХИМИИ» СТУДЕНТОВ
I КУРСА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА
ОМСК – 2007
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ
СБОРНИК ЗАДАНИЙ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ К ЗАНЯТИЯМ ПО «ОБЩЕЙ И
НЕОРГАНИЧЕСКОЙ ХИМИИ» СТУДЕНТОВ
I КУРСА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА
ОМСК – 2007
УДК 61:370.187(075.8)
Сборник заданий для самостоятельной подготовки студентов к занятиям (учебное пособие для студентов 1-ого курса фармацевтического факультета).– Омск: Изд-во Омской гос. мед. академии, 2007. - 48с.
Н.Е. Моисеева, М.В. Галиулина, И.В. Ганзина, О.В. Атавина, Л.Н. Юдина.
Рецензент:
Профессор Е. Г. Атавин – декан химического факультета ГОУ ВПО Омский государственный университет им. Ф. М. Достоевского.
Учебное пособие подготовлено коллективом авторов кафедры общей и биоорганической химии.
Пособие включает 19 заданий по курсу общей и неорганической химии. Задания составлены в соответствии с программой, утвержденной Министерством образования Российской Федерации в 2002 году. Задания включают теоретические вопросы, алгоритмы решения типовых задач, а также условия задач и упражнения для самостоятельного решения. Сборник предназначен для студентов 1-ого курса ОГМА фармацевтического факультета.
Учебное пособие рекомендовано к изданию редакционно-издательским отделом ОГМА
ÓОмская государственная медицинская академия, 2007.
ПРЕДИСЛОВИЕ
Настоящий сборник рекомендован студентам 1-ого курса фармацевтического факультета Омской государственной медицинской академии в качестве пособия для самостоятельной подготовки к лабораторно-практическим и семинарским занятиям, рубежным контрольным работам, зачетам и экзаменам по курсу общей и неорганической химии. Сборник состоит из раздела: «Общая и неорганическая химия» – 19 заданий, соответствующих программе, утвержденной Министерством образования Российской Федерации в 2002 году.
Задания включают наряду с теоретическими вопросами алгоритмы решения типовых задач, а также условия задач и упражнения для самостоятельного решения. Это позволит студентам – первокурсникам закрепить пройденный программный материал, и будет способствовать его более глубокому и прочному усвоению, что очень важно для будущего врача, поскольку химия входит в число наук, составляющих фундамент современной медицины.
Медико-биологическая направленность предлагаемых заданий значительно расширит представления студентов – первокурсников о тесной связи химии и медицины, а также роли химии и ее методов в прогнозировании, диагностике и выявлении молекулярных механизмов возникновения различных заболеваний. Это открывает большие возможности для использования более эффективных средств их профилактики и лечения.
Сборник составлен коллективом авторов на основе их многолетнего опыта преподавания на кафедре общей и биоорганической химии Омской государственной медицинской академии.
Авторы выражают искреннюю благодарность рецензенту Е. Г. Атавину - декану химического факультета ГОУ ВПО Омского государственного университета им. Ф. М. Достоевского за анализ материалов сборника, замечания и полезные советы.
С О Д Е Р Ж А Н И Е
Предисловие......................................................................................................................4
Задание №1. Растворы. Способы выражения концентрации растворов......................6
Задание №2. Введение в титриметрический анализ................................................….10
Задание №3. Метод нейтрализации. Определение содержания натрий гидрок-
сида в растворе........................................................................................13
Задание №4. Оксидиметрия. Перманганатометрия......................................................14
Задание №5. Метод перманганатометрии. Определение содержания пероксида водорода в растворе.................................................................................15
Задание №6. Элементы химической термодинамики...................................................18
Задание №7. Энергетика химических процессов. Биоэнергетика...............................22
Задание №8. Коллигативные свойства растворов. Осмос...........................................24
Задание №9. Водородный показатель среды – рН.......................................................27
Задание №10. Рубежная контрольная работа.....………......................................…….30
Задание №11. Комплексные соединения. Метод комплексонометрии.......................33
Задание №12. Строение атома. Закономерности изменения свойств химических
элементов в периодической системе Д.И. Менделеева……………....36
Задание №13. Строение молекул и химическая связь………………………………......38
Задание №14. Биогенные элементы………………………………...................................40
Задание №15. S –элементы...............................................................……………………42
Задание №16 Общая характеристика Р - элементов……………………………………45
Задание№17 Р - элементы...................................………………………………………...46
Задание№18 Общая характеристика D – элементов. D – элементы IБ – IIБ групп..47
Задание№19 D – элементы VIБ – VIIБ групп…………………………………………….48
ЗАДАНИЕ №1
РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
1. Выучить основные понятия и обозначения по теме: «Растворы. Способы выражения концентрации растворов».
1. Массовая доля растворённого вещества в растворе.
2. Молярная концентрация растворённого вещества в растворе.
3. Химический эквивалент вещества.
4. Молярная концентрация эквивалента вещества в растворе.
5. Титр раствора.
6. Расчёт молярных масс эквивалентов кислот, щелочей, солей, окислителей, восстановителей.
2. Подготовиться к тестированному контролю по теме: «Способы выражения концентрации растворов».
ТИПОВЫЕ ЗАДАЧИ.
Задача №1: Определите молярную концентрацию раствора натрий гидроксида с массовой долей 30%, плотность раствора 1,29 г·см-3.
 Дано: Решение:
Дано: Решение:
w(NaOH)=30% 1.Найти массу 1 дм3 раствора (1дм3=1000 см3).
 rр(NaOH)=1,29 г·см-3 mp = Vp·r = 1000·1,29 = 1290 (г);
rр(NaOH)=1,29 г·см-3 mp = Vp·r = 1000·1,29 = 1290 (г);

С(NaOH)-? 2. Найти массу NaOH в 1 дм3 раствора:


3. Определить молярную массу натрий гидроксида:
М(NaOH) = 40 г·моль-1;
4. 
Определить молярную концентрацию раствора натрий гидроксида:
 |
Ответ: C(NaOH)=9,68 моль·дм-3
Задача №2: Какова массовая доля (%) раствора пероксида водорода Н2О2, применяемого наружно как кровоостанавливающее и дезинфицирующее средство, если молярная концентрация этого раствора составляет 0,89 моль·дм-3, плотность раствора 1 г·см-3?
Дано: Решение:
 C(H2O2)=0,89 моль·дм-3 1. Найти массу 1 дм3 раствора:
C(H2O2)=0,89 моль·дм-3 1. Найти массу 1 дм3 раствора:
rр(H2O2)=1 г·см-3 mp=Vp · r = 1000 · 1 = 1000 (г);
 2. Определить молярную массу пероксида водорода:
2. Определить молярную массу пероксида водорода:
w%(H2O2)-? M(H2O2) = 34 г·моль-1;
3. Найти массу пероксида водорода H2O2:
m(H2O2) = C(H2O2)·M(H2O2)·Vp = 0,89·34·1 = 30,26 (г);
5.
 |
Ответ: w(H2O2) = 3,03 %.
Задача №3: Определите молярную концентрацию эквивалента раствора гептагидрата сульфата магния MgSO4·7H2O, применяемого внутривенно, если массовая доля соли в растворе составляет 20%, плотность раствора 1,22 г·см-3.
 Дано: Решение:
Дано: Решение:
w(MgSO4·7H2O)=20% 1. Найти массу 1 дм3 раствора соли:
rр(MgSO4·7H2O) = 1,22 г·см-3 mр = Vр·r=1000·1,22=1220 (г)
 2. Найти массу соли в 1 дм3 раствора:
2. Найти массу соли в 1 дм3 раствора:
С(1/Z MgSO4·7H2O) -?
 |
 |

4. Определить молярную концентрацию эквивалента раствора:
 |
Ответ: С(1/2 MgSO4·7H2O) = 1,98 моль·дм-3;
Задача №4: Определите титр изотонического раствора натрий хлорида, если в 150 см3 раствора содержится 1,3163 г NaCl.
 |
 Дано: Решение:
Дано: Решение:


t (NaCl) -?

Ответ: t(NaCl)=8,775·10-3 г·см-3.
Задача №5: Определите массовую долю(%) раствора кальций хлорида, применяемого перорально, молярная концентрация эквивалента которого составляет 2 моль·дм-3, плотность раствора 1,11 г·см-3.
Дано: Решение:
 С(1/2 CaCl2)=2 моль·дм-3 1. Найти массу 1 дм3 раствора:
С(1/2 CaCl2)=2 моль·дм-3 1. Найти массу 1 дм3 раствора:
rр(CaCl2)=1,11 г·см-3 mр = Vр·r = 1000·1,11 = 1110 (г);
 2. Определить молярную массу эквивалента кальций
2. Определить молярную массу эквивалента кальций
w%(CaCl2) -? хлорида:
 |
3. Найти массу кальций хлорида в 1 дм3 раствора:

4. Найти массовую долю (%) кальций хлорида в растворе:
 |
Ответ: w(CaCl2) = 10 %.
ЛИТЕРАТУРА:
1. Методическое пособие кафедры по теме: «Способы выражения концентрации растворов».
2. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 42 – 48.
3. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., 1989, с. 94-102.
ЗАДАНИЕ №2
ВВЕДЕНИЕ В ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
I. Выучить следующие вопросы:
1. Принципы титриметрического анализа.
2. Требования титриметрического анализа.
3. Титрование, фиксирование момента эквивалентности.
4. Количественные расчеты в объемном анализе.
II. Подготовиться к тестированному контролю знаний.
ТИПОВЫЕ ЗАДАЧИ.
Задача №1: Рассчитайте объем (см3) раствора серной кислоты с массовой долей 26% (плотность раствора 1,19 г·см-3), необходимого для приготовления 150 см3 раствора серной кислоты с молярной концентрацией 0,2 моль·дм-3.
Дано: Решение:
 w(H2SO4) =26% 1.Определить молярную массу серной кислоты:
w(H2SO4) =26% 1.Определить молярную массу серной кислоты:
rр(H2SO4) = 1,19 г·см-3 M(H2SO4) = 98 г·моль-1;
V1(р-ра) =150 см3 = 0,15 дм3 2.Найти массу вещества серной кислоты в 0,15 дм3
С(H2SO4) =0,2 моль·дм-3 раствора с молярной концентрацией 0,2моль·дм-3:
 m(H2SO4) = C(H2SO4) · M(H2SO4) · V1=0,2·98·0,15 =
m(H2SO4) = C(H2SO4) · M(H2SO4) · V1=0,2·98·0,15 =
V2(р-ра)-? =2,94 (г);
3.Найти массу раствора серной кислоты с w(H2SO4) = 26%:
 |
 |
Ответ: Vp(H2SO4) = 9,5 см3.
Задача №2: Раствор калий перманганата KMnO4 применяется в медицине как дезинфицирующее средство. Рассчитайте титр раствора KMnO4, содержащего 0,02 моль калия перманганата в 250 см3 раствора.
 Дано: Решение:
Дано: Решение:
n(KMnO4) = 0,02 моль 1. Определить молярную массу калий перманганата:
Vp = 250 см3 M(KMnO4)=158 г·моль-1;
 2. Найти массу вещества калий перманганата:
2. Найти массу вещества калий перманганата:
t(KMnO4) -? m(KMnO4)=n(KMnO4)·M(KMnO4)=0,02·158=3,16 (г);
3.Определить титр раствора калий перманганата:
 |
Ответ: t(KMnO4) = 0,01264 г·см-3
Задача №3: Раствор натрий сульфата применяют в медицине перорально как слабительное средство. Сколько граммов натрий сульфата необходимо для приготовления 200 см3 раствора с молярной концентрацией эквивалента С(1/2 Na2SO4)=0,5 моль·дм-3.
 Дано: Решение:
Дано: Решение:
 |

m(Na2SO4)-? 2. Найти искомую массу натрий сульфата:
m(Na2SO4)=C(Na2SO4)·M(Na2SO4)·Vp=0,5·71·0,2=7,1 (г).
Ответ: m(Na2SO4) = 7,1 г.
Задача №4: 25%-ный раствор гептагидрата магний сульфата MgSO4·7H2O применяют внутривенно для снижения давления крови. Определите молярную концентрацию эквивалента этого раствора, плотность раствора 1,15 г·см-3.
Дано: Решение:
 w(MgSO4·7H2O)=25% 1. Определить молярную массу эквивалента гептагидрата
w(MgSO4·7H2O)=25% 1. Определить молярную массу эквивалента гептагидрата

 |
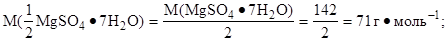 |
2. Найти массу 1 дм3 раствора:
mp = Vp · r = 1000 · 1,15 = 1150 (г);
3. Найти массу соли в 1 дм3 раствора:
 |
4. Определить молярную концентрацию эквивалента соли:
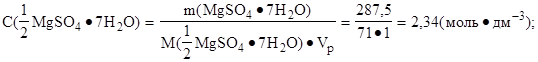 |
Ответ: C(1/2 MgSO4·7H2O) = 2,34 моль·дм-3.
Задача №5: Определите титр раствора натрий гидроксида, если на титрование 5 см3 его раствора израсходовано 5,4 см3 раствора H2SO4 с молярной концентрацией эквивалента С(1/2 H2SO4)=0,5 моль·дм-3.
Дано: Решение:
 V(NaOH) = 5 см3 1.Определить молярную концентрацию эквивалента V(H2SO4) = 5,4 см3 раствора натрий гидроксида:
V(NaOH) = 5 см3 1.Определить молярную концентрацию эквивалента V(H2SO4) = 5,4 см3 раствора натрий гидроксида:
C(1/2 H2SO4) = 0,5 моль·дм-3
 |
C(NaOH)·V(NaOH) = C(1/2 H2SO4)·V(H2SO4);
t(NaOH) -?
 |
2. Определить титр раствора натрий гидроксида:
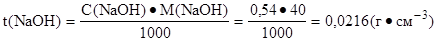 |
Ответ: t(NaOH) = 0,0216 г·см-3.
ЛИТЕРАТУРА:
1. Методическая разработка кафедры «Введение в титриметрический анализ», Омск.
2. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов мед. спец. вузов.- М.: Высшая школа, 2001. – С. 19 – 41.
ЗАДАНИЕ №3
МЕТОД НЕЙТРАЛИЗАЦИИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ НАТРИЙ ГИДРОКСИДА В РАСТВОРЕ
I. Подготовить ответы к следующим вопросам:
1. Сущность метода нейтрализации. Ацидиметрия. Алкалиметрия. Применение метода в клинических и санитарно-гигиенических анализах.
2. Индикаторы метода нейтрализации. Ионная теория индикаторов Оствальда.
3. Зона переходной окраски индикатора. Показатель титрования, его значение.
II. РЕШИТЬ ЗАДАЧИ:
1. Определить молярную концентрацию натрий гидроксида в растворе, если массовая доля его в растворе составляет 26%. (r = 1,3 г·см-3).
Ответ: 8,45 моль·дм-3.
2. Рассчитать массовую долю (%) серной кислоты в растворе (r = 1,12 г·см-3) с молярной концентрацией эквивалента серной кислоты С(1/2 Н2SO4) = 0,5 моль·дм-3.
Ответ: 2,18%
ЛИТЕРАТУРА:
1. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов мед. спец. вузов. – М.: Высшая школа, 2001. – С. 28 - 40.
2. Методическая разработка кафедры «Введение в титриметрический анализ».
Дата добавления: 2015-07-25; просмотров: 82 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Жозе Сарамаго. Евангелие от Иисуса 15 страница | | | ЗАДАНИЕ №4 |