
Читайте также:
|
В отличие от N (оксиды которого термодинамически нестабильны к распаду на азот и кислород) фосфор образует с О очень прочные связи, т.е. его оксиды устойчивы к отщеплению кислорода.
Оксиды фосфора P2O3 и P2O5 синтезируют, сжигая Р при недостатке и избытке О2 соответственно. С водой они дают кислоты: фосфористую H3PO3 и фосфорную H3PO4. (Причем H3PO4 получается через образование вначале метафосфорной кислоты HPO3.)
Все рассмотренные выше фосфорсодержащие вещества – твердые, в отличие от большинства аналогичных соединений азота.
Вследствие невысокой ЭО фосфора его гидроксиды слабы и как кислоты (даже HPO3), и как окислители (с металлами реагируют лишь за счет H+, ибо Р очень устойчив в положительных ст.ок., особенно в высшей.
Поскольку фосфорная кислота трехосновна, то могут быть получены и дигидрофосфаты (в частности, NaH2PO4), и гидрофосфаты (Na2HPO4), и средние соли (Na3PO4).
Из средних растворимы в воде только фосфаты ЩМ, а остальные – лишь в кислотах (как результат образования слабодиссоциирующих гидро- и дигидрофосфат-ионов). Поэтому именно в нейтральной (а не в кислой!) среде нужно проводить качественную реакцию на 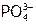 . (Например, с раствором AgNO3, дающим с фосфат-анионами желтый осадок Ag3PO4.)
. (Например, с раствором AgNO3, дающим с фосфат-анионами желтый осадок Ag3PO4.)
Дата добавления: 2015-07-25; просмотров: 83 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Нитраты и нитриты | | | Минеральные удобрения |