
|
Читайте также: |
При добавлении кислоты равновесие смещается вправо как результат связывания ОН–-ионов в Н2О, т.е. идет обычная реакция нейтрализации:
 .
.
При этом образуется соль NH4Cl, которая называется нашатырем или хлоридом аммония. Все соли, содержащие катионы  , стали называть солями аммония.
, стали называть солями аммония.
Подчеркнем, что донорные свойства аммиака из-за наличия НЭП столь сильны, а следовательно, ХС азота с 4-м Н+ столь прочна, что  сохраняет свою целостность при реакциях обмена солей аммония с другими солями или с кислотами:
сохраняет свою целостность при реакциях обмена солей аммония с другими солями или с кислотами:
 ,
,
 .
.
То есть в этих реакциях  подобен обычному катиону, например, K+. Но поскольку соли аммония соответствуют слабому основанию, то в водных растворах идет гидролиз этих солей по катиону и
подобен обычному катиону, например, K+. Но поскольку соли аммония соответствуют слабому основанию, то в водных растворах идет гидролиз этих солей по катиону и  разрушается. Даже сухие соли аммония гидролизуются под действием влаги воздуха. Например:
разрушается. Даже сухие соли аммония гидролизуются под действием влаги воздуха. Например:
 .
.
Образующийся при этом гидрат аммиака легко отщепляет NH3. (Поэтому им пахнут все соли аммония.)
Гидролиз резко усиливается при добавлении щелочи, т.к. ионы ОН–, связывая протоны в молекулы очень слабого электролита Н2О, переводят  в гидрат аммиака практически полностью:
в гидрат аммиака практически полностью:
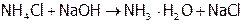 .
.
(Данная реакция является качественной на ионы аммония – их присутствие легко устанавливается по запаху, характерному для аммиака). Разрушается  также при нагревании раствора, например, нашатыря, а тем более сухой соли:
также при нагревании раствора, например, нашатыря, а тем более сухой соли:
 .
.
При этом разрываются химические связи (между NH3 и H+), поэтому процесс называется химической возгонкой (в отличие от физической возгонки, например, I2, идущей без разрушения ХС). Если получающиеся газы (NH3 и HCl) по газоотводной трубке направить в другой (не нагреваемый) сосуд, то, охлаждаясь в нем, они снова образуют соль NH4Cl.
Возгонка солей аммония используется для отделения их от нелетучих веществ (в частности, NaCl). Кроме того, способность нашатыря разлагаться помогает, например, очищать поверхность медного паяльника от оксида меди. А именно: хлороводород (он образуется из хлорида аммония на горячем паяльнике) реагирует с оксидом меди:
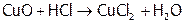 ,
,
а NH3 восстанавливает медь в CuCl2 до Cu0 (другие продукты: N2 и HCl).
Дата добавления: 2015-07-25; просмотров: 58 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Физические и химические свойства | | | Получение оксидов и кислот |