
Читайте также:
|
ПС IIIА
| B | неметалл |
| Al | металлы |
| Ga | |
| In | |
| Tl | металл радиоактивный |
с ростом величины порядкового номера в главной подгруппе металлические свойства
(физ.смысл) размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «Al – Tl»
строение внешней е-оболочки..s2p1, р-элементы ПР: +13Al 1s22s2р63s2р1
3s 3p 3d
 |  |  |  |  |  |  |  |  |
2s 2p
 | |||||||||
 |  |  |  | ||||||
1s
 |
Al
+13
при возбуждении е- распариваются и переходят от s-орбитали на свободные р-орбитали,
возможна гибридизация,
атомы элементов IIIА группы проявляют низкую электроотрицательность,
валентные e- легко отсоединяются,
металлы IIIА группы – восстановители
ПР: Al 0 - 3e- ® Al +3
«элементы главных подгрупп проявляют сходную степень окисления»
(физ.смысл) окисление – процесс отдачи е-, степень окисления - количество отданных е-,
элементы главных подгрупп отдают “s”-“р”e- внешнего эн.уровня,
имея общую структуру валентных е-, они проявляют сходную степень окисления,
ст.окисления и валентность бора 0 +3
алюминия 0 +3 (III)
таллий 0 +1 +3 (редко)
номер группы, как правило, равен max(+)степени окисления хим.элементов данной группы
ПР: IIIА max(+)степень окисления +3
с ростом величины порядкового номера в главной подгруппе восстановительные свойства
(физ.смысл) размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «Al - Tl»
высшие оксиды
| R2O3 | ||
| В2O3 | кислотный ® кислота Н3ВO3 | |
| Al2O3 | амфотерные ® амфотерные гидроксиды | |
| Ga2O3 | ||
| In2O3 | ||
| Tl2O3 | основной ® основание |
с ростом порядкового номера в главной подгруппе основные свойства высших оксидов
с ростом порядкового номера в главной подгруппе сила оснований высших оксидов
(физ.смысл) размеры центр.атома , его связь с группой НО- уменьшается, эл.диссоциация усиливается
алюминий распространен в природе - 9% от массы земной коры(третий по распространенности после О-Si)
в природе алюминий встречается в виде хим.соединений
нахождение в природе оксида алюминия
ПР: Al2O3 корунд, рубин красный(примесь Cr), сапфир синий(примесь Ti Fe)
входит в состав различных в-в
Al2O3*2SiO2*2H2O каолинит
K2O*Al2O3*6SiO2 полевой шпат
Al2O3*nH2O бокситы
Na2O*Al2O3*2SiO2 нефелин
физ. и хим.свойства алюминия
АЛЮМИНИЙ Al
1.2. AlCl3 + 3K T ® 3KCl + Al без доступа воздуха
1.3. электролиз бокситов Al2O3 в расплаве криолита Na3(AlF6)1000°С (добавляют CaF2)
идет эл.диссоциация Al2O3 ® Al3+ + AlO33-
на катоде на аноде

 Al3+ + 3e- ® Al 4AlO32-- 12e- ® 2Al2O3 + 3О2
Al3+ + 3e- ® Al 4AlO32-- 12e- ® 2Al2O3 + 3О2
2Al2O3 электролиз ® 4Al + 3O2 сопровождается сгоранием угольного электрода
2. тв.прочный-пластичный-е-проводник и теплопроводник-непрозрачный с Ме блеском, ТплавAl=660°С, rAl=2,7
3. металл амфотерный
*2Al амальгама алюминия + 6Н2О ® 2Al(OH)3¯ + 3H2
*2Al + 6HCl ® 2AlCl3 + 3H2
2Al + 3H2SO4 ® Al2(SO4)3 + 3H2
*Al + 2NaOH + 2Н2О ® 2Na[Al(ОН)4] + 3H2
2Al + 2NaOH + 2Н2О T ® 2NaAlО2 + 3H2
активный металл- восстановитель
*4Al + 3O2 ® 2Al2O3 прочная пленка на поверхности защищает Al от коррозии
4Al + 3O2 T ® 2Al2O3 вдувание порошка Al в пламя
2Al + 3I2 T ® Н2О 2AlI3
2Al + 3Br2 T ® 2AlBr3
2Al + 3Cl2 T ® 2AlCl3
 3S + 2Al T Al2S3
3S + 2Al T Al2S3
2Al + N2 T ® 2AlN
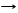 3C + 4Al T Al4C3 карбид алюминия
3C + 4Al T Al4C3 карбид алюминия
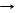 P + Al T AlP
P + Al T AlP
*8Al + 3Fe3O4 T ® 2Al2O3 + 9Fe горение термита, который дает яркое свечение и высокую температуру
2Al + WO3 T ® W + 2Al2O3 принцип алюминотермии
Cr2O3 + 2Al Т ® Al2O3 + 2Cr
3MnO2 + 4Al Т ® 2Al2O3 + 3Mn
*2Al + 3CuSO4 T ® Al2(SO4)3 + 3Cu¯
*Al + 4HNO3 ® Al(NO3)3 + NO + 2H2O
8Al + 15H2SO4конц T ® 4Al2(SO4)3 + 3Н2S + 12H2O
2Al + 6H2SO4конц T ® Al2(SO4)3 + 3SО2 + 6H2O
Al + 6HNO3конц T ® Al(NO3)3 + 3NO2 + 3H2O
применение алюминия и его сплавов, алюмотермия
4. электропровода
сплавы дюралюминий (Al + Cu,Mg) силумин (Al + Si) в авиастроении-автостроении-судостроении-строительстве..
алюминотермия – получение Mn Cr W..
физ. и хим.свойства оксида алюминия
ОКСИД АЛЮМИНИЯ Al2O3
1.2. 4Al + 3O2 T ® 2Al2O3 вдувание порошка Al в пламя
2Al(OH)3 T ® Al2O3 + 3H2O
2. тв. очень прочный-тугоплавкий ТплавAl=2000°С, не растворим Н2О
3. неактивен
амфотерный оксид, не реагирует с водой
*Al2О3 + 6HCl T ® 2AlCl3 + 3H2О
Al2О3 + 6КНSO4 T ® Al2(SO4)3 + 3K2SO4 + 3H2O
*Al2О3 + 2NaOH + Н2О ® 2Na[Al(OH)4]
Al2О3 + 2NaOH T ® 2NaAlO2 + H2О сплавление
*Al2О3 + Na2CO3 T ® 2NaAlO2 + CО2 сплавление
4. абразивный материал
получение алюминия
драгоценности
получение, физ. и хим.свойства гидроксида алюминия
ГИДРОКСИД АЛЮМИНИЯ Al(OH)3
1.2. AlCl3 + 3NaOH ® 2Al(OH)3¯ + 3NaCl!в избытке щелочи образуется Na[Al(OH)4]
AlCl3 + 3(NH3*H2O) ® 2Al(OH)3¯ + 3NH4Cl
Al2S3 + 6H2O ® 2Al(OH)3¯ + 3H2S
2Na[Al(OH)4] + CO2 ® 2Al(OH)3¯ + Na2CO3
2. тв.белый, нерастворимый
3. амфотерное основание
*электролитическая диссоциация ступенчатая
Al(OH)3 Û Al3+ + 3OH- или Al(OH)3 + H2О Û H+ + [Al(OH)4]-
реакции обмена(условия необратимости реакции..)
 *Al(OH)3 + HCl Al(OH)2Cl + H2O реакция нейтрализации
*Al(OH)3 + HCl Al(OH)2Cl + H2O реакция нейтрализации
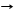 Al(OH)3 + NaOH T NaAlO2 + 2H2O сплавление
Al(OH)3 + NaOH T NaAlO2 + 2H2O сплавление
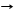 Al(OH)3 + NaOH Na[Al(OH)4]
Al(OH)3 + NaOH Na[Al(OH)4]
*реакция разложения
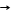 2Al(OH)3 T Al2O3 + 3H2O
2Al(OH)3 T Al2O3 + 3H2O
положение железа в периодической системе, степени окисления
Дата добавления: 2015-07-25; просмотров: 160 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Н.у.) тв.мягкий-пластичный-с Ме блеском-легкоплавкий-легкий | | | Триада железа Fe Co Ni |