
Читайте также:
|
Раздел химии, изучающий скорости и механизмы химических реакций и влияние на них различных факторов, называется химической кинетикой.
Скорость гомогенной реакции определяется изменением концентрации одного из вступивших в реакцию или образующихся в результате реакции веществ в единицу времени:  ; где С – концентрация,
; где С – концентрация,  - время.
- время.
Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате реакции в единицу времени на единице поверхности фазы.
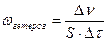 ;
;
где ν-количество вещества; τ-время; S-площадь поверхности
Важнейшими факторами, влияющими на скорость реакций, являются: природа реагирующих веществ, температура, концентрация реагентов, давление, катализатор.
Количественная зависимость скорости реакции от концентрации реагентов описывается законом действующих масс: Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, равные соответствующим коэффициентам в уравнении реакции. Например для реакции:
а А + b В = с С + d D
ωпрямой = к[A]a·[B]b,
где к- константа скорости реакции;
[A],[B]-молярные концентрации реагирующих веществ
Для гетерогенных реакций концентрации твердой фазы в выражение скорости реакции не входит.
Скорость большинства реакций увеличивается в 2-4 раза при повышении температуры на 10 градусов (правило Вант-Гоффа). Величина, показывающая, во сколько раз возрастает скорость данной реакции при увеличении температуры на каждые 10 градусов, называется температурным коэффициентом.
 ,
,
где t2 и t1 - температура реакции;
 - скорость реакции при данных температурах;
- скорость реакции при данных температурах;
γ - температурный коэффициент.
Если реакция протекает только в одном направлении, она называется необратимой. Обратимыми называются реакции, которые могут протекать одновременно в противоположных направлениях:
a A + b B ↔ c C + d D
Состояние процесса, в котором скорость прямой и обратной реакции равны, называется химическим равновесием. В этом случае
ωпрямой = ωобратной, т.е. кпр[A]a·[B]b= кобр[C]c·[D]d
Отношение констант прямой и обратной реакций называется константой равновесия: 
Константа химического равновесия зависит от природы реагентов и температуры, но не зависит от концентрации реагирующих веществ и катализатора.
При неизменных условиях состояние химического равновесия сохраняется сколь угодно долго. Сместить его в сторону прямой или обратной реакции можно, изменяя внешние условия протекания реакций
(температуру, концентрацию веществ, давление).
Направление смещения химического равновесия определяется принципом Ле-Шателье (1884 г.): Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то равновесие сместится в сторону уменьшения этого воздействия.
Пример 1. Определите, как изменится скорость прямой реакции
2СО + О2 = 2СО2 если давление в системе увеличить в 4 раза.
Решение: При увеличение давления в системе в 4 раза произойдет уменьшение объёма системы в 4 раза, а следовательно концентрации реагирующих веществ возрастет в 4 раза.
Согласно закону действующих масс скорость гомогенной реакции в начальный момент времени равна ω1 = к [CO]2 · [O2], после увеличения давления ω2 = к [4CO]2 · [4O2] = 43 к [CO]2 · [O2] = 64 к [CO]2 · [O2]
Следовательно после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Пример 2. Температурный коэффициент скорости реакции равен 3. Во сколько раз изменится скорость реакции при повышении температуры от 15 до 55оС?
Решение: Определим на сколько градусов повысилась температура
Δt = t1 – t2 = 55 – 15 = 40. Используя правило Вант- Гоффа определяем во сколько раз возрастет скорость реакции  следовательно
следовательно  = 34=81 раз.
= 34=81 раз.
Пример 3. Исходные концентрации водорода и азота равны соответственно 0,6 и 1 моль/дм3. К моменту равновесия прореагировало 50% водорода. Вычислите Кравн реакции синтеза аммиака.
Решение: Реакция протекает по уравнению 3Н2 (г)+ N2(г)↔ 2NH3(г). Если прореагировало 50% водорода т.е. 0,3 моль/дм3, следовательно равновесная концентрация водорода [H2]равн= 0,6 – 0,3 = 0,3 моль/дм3. По уравнению реакции азота прореагирует в три раза меньше, т.е. 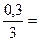 0,1моль/дм3, следовательно равновесная концентрация азота [N2]равн= 1-0,1 = 0,9 моль/дм3. Количество образовавшегося аммиака будет равно 0,2 моль/дм3, т.е. [NH3]равн=0,2 моль/дм3. Для данной реакции Кравн вычисляем по формуле:
0,1моль/дм3, следовательно равновесная концентрация азота [N2]равн= 1-0,1 = 0,9 моль/дм3. Количество образовавшегося аммиака будет равно 0,2 моль/дм3, т.е. [NH3]равн=0,2 моль/дм3. Для данной реакции Кравн вычисляем по формуле: 
Дата добавления: 2015-07-25; просмотров: 57 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Контрольные задачи | | | Контрольные задачи |