
Читайте также:
|
1. Что такое ковалентная связь? Приведите схему перекрывания электронных облаков при образовании молекул Н2 и Н2О.
2. Что такое насыщаемость ковалентной связи? Распределите электроны
внешнего энергетического уровня атома хлора по квантовым ячейкам. Как объясняет спиновая теория наличие у хлора нечетной переменной валентности?
3. Что такое направленность ковалентной связи? Объясните, почему молекула BF3 имеет симметричную треугольную форму.
4. Определите тип химической связи в молекулах BaCl2, HI, N2. Для двух последних приведите схему перекрывания электронных облаков.
5. Пользуясь таблицей электроотрицательностей, вычислите ΔОЭО для связей К-Cl, Са-Cl, Т1-Cl, Fe-Cl. Почему происходит закономерное уменьшение значений ΔОЭО? Какая из связей характеризуется наибольшей степенью ионности?
6. Что такое σ-, π- и б‑ связи? Разберите, сколько σ-, π- связей в молекуле азота. Приведите схему перекрывания электронных облаков в этой молекуле.
7. Что такое гибридизация атомных орбиталей? Как метод ВС объясняет тетраэдрическое строение молекулы метана СН4?
8. Какой тип связи осуществляется в кристаллах металлов? Чем отличается структура кристаллов NaCl от структуры кристаллов Na? Какой вид связи осуществляется в этих кристаллах? Какие кристаллические решетки имеют натрий и NaCl?
9. Какую химическую связь называют водородной? Между молекулами
каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
10. Какую химическую связь называют координационной или донорно-акцепторной? Разберите строение комплексного иона [NH4]+. Укажите донор, акцептор. Как метод ВС объясняет тетраэдрическое строение этого иона?
11. Что такое гибридизация атомных орбиталей? Как метод ВС объясняет линейное строение молекулы ВеCl2? Приведите схему перекрывания электронных облаков.
12. Что такое насыщаемость ковалентной связи? Объясните с позиций метода ВС, может ли существовать ион NH52+?
13. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк имеют указанные структуры? Что такое плазма?
14. Составьте электронные схемы строения молекул Cl2, H2S, N2. В каких
молекулах ковалентная связь является полярной? Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S?
15. Какую валентность, обусловленную неспаренными электронами, может проявить фосфор в нормальном и возбужденном состояниях?
16. Какую химическую связь называют координационной или донорно-акцепторной? Разберите строение комплексного иона [BF4]-. Укажите донор, акцептор. Как метод ВС объясняет тетраэдрическое строение этого иона?
17. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Приведите по одному примеру. Как зависят свойства кристаллических веществ от типа химической связи?
18. Что называют дипольным моментом? Почему молекулы НCl более по
лярные, чем HI?
19. Что такое спин-валентность? Объясните с позиций метода ВС, почему
Cl имеет переменную валентность, а фтор — постоянную?
20. Что такое гибридизация атомных орбиталей? Как метод ВС объясняет строение молекулы CH4? Приведите схему перекрывания электронных облаков.
21. Что такое ионная связь? Приведите примеры. Разберите процесс образования оксида кальция с точки зрения перестройки электронных структур кальция и кислорода.
22. Определите тип химической связи в молекулах NaCl, HCl, Cl2. Для двух последних приведите схему перекрывания электронных облаков.
23. Что такое гибридизация атомных орбиталей? Как метод ВС объясняет строение молекулы NH3? Приведите схему перекрывания электронных облаков.
24. Что такое насыщаемость ковалентной связи? Распределите электроны
внешнего энергетического уровня атома серы по квантовым ячейкам. Как объясняет спиновая теория наличие у серы четной переменной валентности?
25. Что такое направленность ковалентной связи? Объясните, почему молекула CH4 имеет форму тетраэдра?
Тема 5. Энергетика химических процессов и химическое сродство (термохимические и некоторые термодинамические расчеты)
Термодинамика - наука о превращении одних форм энергии в другие на основе закона сохранения энергии. Термодинамика устанавливает направление самопроизвольного течения химических реакций при данных условиях. При химических реакциях рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Сумма энергий связей после реакции не равна сумме энергий связи до реакции, т. е. протекание химической реакции всегда сопровождается выделением или поглощением энергии, причем формы ее различны.
Термохимия - раздел термодинамики, посвященный изучению тепловых эффектов реакций. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называют энтальпией реакции (ΔН) и выражают в джоулях (Дж) и килоджоулях (кДж).
Для экзотермических реакций ΔН<0, для эндотермических — ΔН>0. Энтальпию образования 1 моль данного вещества из простых веществ, измеренную при температуре 298 К (25°С) и давлении 101,3 кПа (1 атм), называют стандартной ΔНº298 (кДж/моль). Энтальпии простых веществ условно принимают равными нулю.
В основе термохимических расчетов лежит закон Гесса (1840): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект химической реакции (ΔНх.р.) равен сумме теплот образования ΔНобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:
ΔНх.р. = Σ ΔНºобр.продуктов – ΣΔНºобр.исходных веществ
В термохимических уравнениях указывают значение энтальпии химической реакции ΔНх.р. При этом у формулы каждого вещества указывают его физическое состояние: газообразное (г), жидкое (ж), твердое кристаллическое (к).
В термохимических уравнениях тепловые эффекты реакций дают в расчете на 1 моль исходного или конечного вещества. Поэтому здесь допускаются дробные коэффициенты. При химических реакциях проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации) — уменьшению Н, а с другой стороны – к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая — с ее повышением. Тенденцию к беспорядку характеризует величина, названная энтропией S [Дж/(моль·К)]. Она является мерой неупорядоченности системы. Энтропия пропорциональна количеству вещества и возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, ослаблении или разрыве связей между атомами и т. п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т. п. — ведут к уменьшению энтропии. Энтропия — функция состояния, т. е.
ΔSх.р. = Σ Sпродуктов – Σ Sисходных веществ
Общая движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (S). При p=const и Т=const общую движущую силу процесса (ΔG) можно представить следующим образом: ΔG = ΔH – TΔS.
Энергия Гиббса ΔG, или изобарно-изотермический потенциал, также подчиняется следствию закона Гесса:
ΔGх.р. = Σ ΔGºобр.продуктов – Σ ΔGº обр.исходных веществ
Самопроизвольно протекают процессы, идущие в сторону уменьшения любого потенциала и, в частности, в сторону уменьшения ΔG. При состоянии равновесия ΔG = 0; ΔH = TΔS температура начала равновесной реакции равна: Травн = 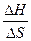 .
.
Данные, необходимые для решения задач этого раздела, приведены в таблице:
Стандартные теплоты (энтальпии) ΔНº298 образования, абсолютные
энтропии Sº298,энергия Гиббса ΔGº298 некоторых веществ.
| Вещество, (агрегатное состояние) | ΔНº298 кДж/моль | Sº298 Дж/моль·К | ΔGº298 кДж/моль |
| Al2O3(к) | - 1669,80 | 0,986 | - 2213,21 |
| Fe2O3(к) | - 822,10 | 90,0 | - 741,0 |
| FeO(к) | - 266,52 | 54,0 | - 244,3 |
| Fe3O4(к) | - 1117,1 | 146,4 | - 1014,2 |
| CaO(к) | - 635,6 | 39,7 | - 604,2 |
| CaCO3(к) | - 1206,87 | 88,7 | - 1128,75 |
| Ca(OH)2(к) | - 986,50 | 76,1 | - 896,96 |
| BeO(к) | - 610,9 | 14,10 | - 581,61 |
| BaO(к) | - 558,1 | 70,3 | - 528,4 |
| BaCO3(к) | - 1218,8 | 112,1 | - 1138,8 |
| N2(г) | 191.489 | ||
| NH3(г) | - 46,19 | 192,50 | - 16,636 |
| NH4Cl(к) | - 315,39 | 94,5 | - 203,88 |
| NO(г) | + 90,37 | 210,20 | + 86,69 |
| NO2(г) | + 33,5 | 240,46 | + 51,84 |
| O2(г) | 205,03 | ||
| Cl2(г) | 222,95 | ||
| C(алмаз) | 1,896 | 2,44 | 2,866 |
| C(графит) | 5,69 | ||
| CS2(г) | + 115,28 | 237,82 | 65,06 |
| CO(г) | - 110,52 | 197,91 | - 137,27 |
| CO2(г) | - 393,51 | 213,65 | - 394,38 |
| H2(г) | 130,59 | ||
| H2O(ж) | - 285,84 | 69,94 | - 237,19 |
| H2O(г) | - 241,83 | 188,72 | - 228,59 |
| H2S(г) | - 20,15 | 205,64 | - 33,020 |
| HCl(г) | - 92,31 | 186,68 | - 95,265 |
| C2H2(г) | + 226,8 | 200,82 | + 209,20 |
| C6H6(г) | + 82,93 | 269,2 | |
| C2H4(г) | + 52,28 | 219,45 | 68,11 |
| CH4(г) | - 74,85 | 186,19 | - 50,79 |
| C2H6(г) | - 84,67 | 229,5 | |
| CH3OH(ж) | - 238,7 | 126,8 | |
| CH3OH(г) | - 201,17 | 239,7 | |
| C2H5OH(г) | - 235,31 | 282,0 |
Пример 1. Газообразный этиловый спирт можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакцию вступило 10 л С2Н4 при нормальных условиях?
Решение. Составим термохимическое уравнение реакции:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г), ΔΗх.р.=?
Необходимое значение теплового эффекта реакции вычислим, применяя следствие закона Гесса:
ΔНх.р. = ΔНºобр.(С2Н5ОН) – ΔНºобр.(С2Н4) – ΔНºобр.(Н2О).
Подставляем значения ΔН из таблицы 1.
ΔНх.р.= - 235,31 - 52,28-(-241,84) = -45,76 кДж.
Один моль газообразных веществ (н. у.) занимает объем 22,4 л (дм3). Используя это следствие закона Авогадро, можно составить пропорцию:
Из 22,4 л С2Н4 выделяется 45,76 кДж, следовательно
10 л С2Н4 выделяется - Х
Отсюда при вступлении в реакцию 10 л С2Н4 выделяется 20,43 кДж теплоты.
Пример 2. На основании стандартных теплот образования и абсолютных стандартных энтропии веществ вычислите ΔG°298 реакции
NH3 (г) + НС1 (г) = NH4Cl (к)
Чем можно объяснить то, что ΔS<0?
Решение. ΔG° определяем из уравнения ΔG° = ΔН°—TΔS0, где ΔН и ΔS — функции состояния. Поэтому
ΔНх.р. = Σ ΔНºобр.продуктов – Σ ΔНºобр.исходных веществ;
ΔSх.р. = Σ Sºпродуктов – Σ Sºисходных веществ;
ΔНºх.р.=- 315,39 - (- 46,19) - (- 92,31) = - 176,89 кДж/моль;
ΔSºх.р. = +94,5 - 192,50 - 186,68 = - 284,68 Дж/(моль·К);
ΔG° = - 176,89 - 298 (- 0,2847) = - 92,08 кДж.
Энтропия есть мера неупорядоченности состояния вещества. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества, и возможность хаотического движения молекул газа больше. Следовательно, при уменьшении объема системы движение молекул затрудняется и энтропия системы уменьшается. В данном примере из 2 моль газов получается 1 моль кристаллического вещества — объем и ΔS системы уменьшаются.
Дата добавления: 2015-07-25; просмотров: 173 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тема 4. Химическая связь | | | Контрольные задачи |