
Читайте также:
|
Объединяя законы Бойля - Мариотта и Гей-Люссака, можно получить следующее уравнение: 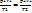 , которое является математическим выражением объединенного газового закона, или закона состояния газов. Он позволяет вычислить, например, объем газа при определенных температуре и давлении, если известен его объем при других значениях температуры и давления. Объединенный газовый закон можно также записать в другой форме:
, которое является математическим выражением объединенного газового закона, или закона состояния газов. Он позволяет вычислить, например, объем газа при определенных температуре и давлении, если известен его объем при других значениях температуры и давления. Объединенный газовый закон можно также записать в другой форме: 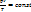 . Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю, то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значениеR = 8,314 Дж*К* моль-1. Объединенный газовый закон для одного моля газа приобретает вид:
. Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю, то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значениеR = 8,314 Дж*К* моль-1. Объединенный газовый закон для одного моля газа приобретает вид: 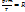 , где Vm- объем одного моля газа. Для п молей газа получается уравнение:
, где Vm- объем одного моля газа. Для п молей газа получается уравнение: 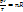 или
или 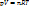 . В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру. Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах.
. В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру. Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах.
Уравнение Клапейрона-Менделеева.
Связь между числом молей газа, его температурой, объемом и давлением. Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных. Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева): PV = nRT, где n – число молей газа; P – давление газа (например, в атм; V – объем газа (в литрах); T – температура газа (в кельвинах); R – газовая постоянная (0,0821 л·атм/моль·K).
__________________________________________________________________________________________________________________________________________________________________________________________
2 ВОПРОС
Дата добавления: 2015-07-25; просмотров: 130 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Закон Гей-Люссака | | | Строение атома |