
Читайте также:
|
Влияние концентрации реагирующих веществ на химическое равновесие рассмотрим на примере взаимодействия между хлоридом железа (III) и роданидом калия. В результате протекания реакции образуется роданид железа (III), при этом раствор окрашивается в красный цвет, интенсивность которого зависит от концентрации вещества Fe(SCN)3.
Смещение равновесия легко наблюдать по изменению интенсивности окраски раствора. Реакция протекает по уравнению:
FeCl3 + 3KSCN «Fe(SCN)3 + 3KCl
Реактивы и растворы хлорида железа (III) (0,002 моль/л), роданида калия оборудование: (0,006 моль/л), кристаллический хлорид калия;
штатив с пробирками, стакан на 100 мл, стеклянные палочки,
капельницы с насыщенными растворами хлорида железа (III) и роданида калия.
Смешайте в стакане 10 мл 0,002 моль/л раствора хлорида железа (III) и 10 мл 0,006 моль/л раствора роданида калия. Получится раствор с характерной красной окраской, обусловленной присутствием малодиссоциированных молекул Fe(SCN)3. Разлить полученный красный раствор поровну в 4 пробирки, 1-ую пробирку оставить для сравнения.
Во 2-ую добавить несколько капель насыщенного раствора хлорида железа (III), в 3-ю – несколько капель насыщенного раствора роданида калия. Перемешать растворы в пробирках. Во 2-ой и 3-ей пробирках окраска раствора усиливается.
В 4-ю пробирку прибавить сухую соль хлорида калия и энергично перемешать стеклянной палочкой. Окраска раствора по мере растворения KCl заметно ослабляется. Пользуясь выражением для константы химического равновесия.
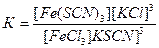
объяснить изменение окраски растворов во 2-ой, 3-й и 4-й пробирках. Как можно довести обратимую реакцию практически до конца?
Дата добавления: 2015-07-12; просмотров: 173 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Влияние концентрации на скорость химической реакции | | | Упражнения и задачи |