
|
Читайте также: |
Электролиты – вещества, водные растворы и расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания, соли.
Электролитическая диссоциация – процесс распада электролита на ионы под воздействием молекул растворителя.
Примеры:
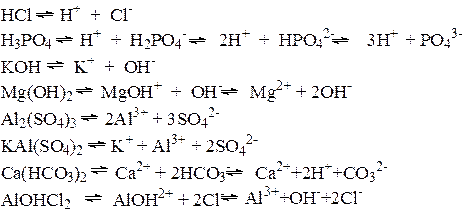
Поскольку вещества электронейтральны, общее число положительных зарядов катионов равно общему числу отрицательных зарядов анионов.
По степени электролитической диссоциации (a) различают электролиты: сильные (a>30%), средние (2%<a<30%), слабые (a<2%).
Сильные электролиты:
- многие минеральные кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4, HClO3, HMnO4;
- основания щелочных и щелочноземельных металлов;
- почти все растворимые соли (исключения: HgCl2, CdCl2, CdI2, Fe(CNS)3 и некоторые другие);
Слабые электролиты:
- некоторые минеральные кислоты: H2CO3, H2S, H2SO3, HNO2, HClO;
- органические кислоты;
- H2O;
- NH4OH, основания большинства металлов (кроме щелочных и щелочно-земельных).
Ортофосфорная кислота H3PO4 – электролит средней силы.
По теории электролитической диссоциации все реакции электролитов в водных растворах являются реакциями между ионами. Такие реакции представляют в виде ионных уравнений. При составлении ионных уравнений реакций каждое вещество записывается в той форме, которая для данного равновесного состояния в растворе является преобладающей.
В виде ионов изображают только сильные растворимые электролиты, все остальные вещества (малодиссоциированные, малорастворимые, газообразные, а также неэлектролиты) записываются в молекулярном виде. Знак ¯ при формуле вещества показывает, что это вещество удаляется из сферы реакции в виде осадка, знак - в виде газа.
Сумма зарядов левой части уравнения должна быть равна сумме зарядов правой части.
Составление уравнений реакций электролитов рекомендуется выполнять в определенной последовательности:
1. Составить молекулярное уравнение.
2. Определить природу исходных и образующихся веществ (сильный и слабый электролит, растворимый или малорастворимый).
3. Переписать уравнение, изобразив каждое вещество в соответствующей форме (в виде ионов – сильные электролиты, в виде молекул - все остальные вещества).
4. Сравнить состав реагирующих и образующихся частиц, выявить одинаковые, следовательно, не принимающие участия в реакции, ионы.
5. Исключить одинаковые ионы, написать сокращенное ионно – молекулярное уравнение.
6. Сделать вывод о возможности необратимого протекания реакции. Необратимо протекают реакции в направлении наибольшего связывания ионов с образованием осадков, газов, слабых электролитов и комплексных ионов.
Если связывания ионов нет, то с точки зрения теории электролитической диссоциации реакция не происходит, но при выпаривании раствора образуется смесь из исходных веществ и продуктов их обмена.
Дата добавления: 2015-07-12; просмотров: 361 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Упражнения и задачи | | | Пример 2 |