
|
Читайте также: |
Вольтамперометрическими называют методы анализа, основанные на регистрации и изучении зависимости тока, протекающего через электролитическую ячейку, от внешнего наложенного напряжения. Графическое изображение этой зависимости называют вольтамперограммой. Анализ вольтамперограммы дает информацию о качественном и количественном составах анализируемого раствора.
Для регистрации вольтамперограмм нужна электролитическая ячейка, состоящая из индикаторного электрода и электрода сравнения.
Электродом сравнения обычно служит каломельный электрод или слой ртути на дне электролизера. В качестве индикаторного используют ртутный капающий электрод, микродисковые платиновый.
В зависимости от типа индикаторного электрода вольтамперометрические методы принято делить на полярографию и собственно вольтамперометрию. Если в качестве индикаторного электрода используют ртутный капающий электрод, то полученные зависимости силы тока от напряжения называют полярографией.
Для регистрации классических полярограмм ячейку с капающим ртутным индикаторным электродом и насыщенным каломельным электродом сравнения через калиброванное линейное сопротивление присоединяют к источнику постоянного напряжения и изменяют потенциал со скоростью 2 – 5 мВ/с.
Перед регистрацией полярограммы необходимо удалить растворенный кислород, поскольку он электроактивен. Сделать это можно, насыщая раствор инертным газом (азот, аргон, гелий).
Классическая полярограмма характеризуют 3 параметра: сила тока, потенциал в точке максимального наклона и исследования.
Как видно из рисунка полярограмма состоит из 3 участков: полового участка А – Б от начала регистрации полярограммы до начала электрохимической реакции, участка Б – В, характеризующегося резким подъемом тока за счет электрохимической реакции и участок В – Г, соответствующего установлению практически постоянного значения тока. Подъем тока в точке Г обусловлен новой электрохимической реакцией.
В основе качественного полярографического анализа лежит величина потенциала полуволны, характеризующая природу деполяризатора. Его числовое значение показывает, насколько легко восстанавливаетсят на электроде данное вещество: чем менее отрицателен Е1/2, тем легче протекает восстановление. Потенциал полуволны непосредственно связан со стандартным потенциалом данной оксилительно–восстановительной системы, поэтому Е1/2 для одного и того же деполяризатора будет зависеть от состава фонового электролита.
Скорость вытекания ртути постоянна и что капля имеет правильную сферическую форму вплоть до момента отрыва от капилляра. На основании этих предположений можно прийти по уравнению Ильковича:
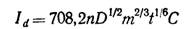
где Iд — диффузионный ток, m — скорость вытекания ртути (мг/с). В числовой множитель входят геометрические факторы, константа Фарадея и плотность ртути.
Если зависимость тока от времени изобразить графически, то наблюдаются флуктуации тока с периодом в несколько секунд. Период капания можно варьировать, изменяя высоту столбика ртути, или электромеханически, стряхивая капли с кончика капилляра через равномерные промежутки времени. Время жизни капли слабо зависит от величины наложенного потенциала, достигая максимума при потенциале около –0,5 В относительно НКЭ.
Хотя температура в явном виде не входит в уравнение Ильковича, тем не менее это очень важный параметр, так как каждый фактор (кроме п) в этом уравнении в какой-то степени зависит от температуры. Влияние температуры проявляется главным образом через коэффициент диффузии D. При повышении температуры на один градус в интервале комнатных температур диффузионный ток возрастает на 1 – 2 процента. Поэтому при точных измерениях температуру необходимо контролировать с точностью до нескольких десятых градуса. Для качественных же и полуколичественных работ это не обязательно.
Диффузионный ток зависит также от концентрации фонового электролита; если концентрация последнего в 25 или 30 раз ниже концентрации восстанавливающегося вещества, величина диффузионного тока отличается от его нормальной величины, потому что в этих условиях восстанавливающиеся ионы переносят заметную долю тока и в результате кулоновских взаимодействий ионов с РКЭ возникает миграционный ток и уравнение Ильковича не выполняется, поскольку диффузия уже не является единственным способом массопереноса восстанавливающихся частиц к электроду.
Уравнение полярографической волны Ильковича-Гейровского.
Рассмотрим электролиз в системе, где катодом служит ртутный капающий электрод, а анодом является практически неполяризуемый каломельный электрод. Если в растворе нет веществ, способных восстанавливаться под действием электрического тока, сила тока будет пропорциональна приложенному напряжению Е (закон Ома): 1=E/R.
В присутствии веществ, способных восстанавливаться на ртутном электроде в области исследуемых напряжений по достижении потенциала восстановления ионы начнут разряжаться на ртутном катоде (нередко с образованием амальгамы):
Мn++ne-+ Hg=M (Hg)
Потенциал ртутного катода, на котором протекает обратимый процесс, выражается уравнением Нернста:

где Са – концентрация амальгамы; γa – ее коэффициент активности; См – концентрация восстанавливающихся ионов в приэлектродном слое (заряд иона для простоты опущен); γМ – его коэффициент активности; аHg – активность ртути в амальгаме; Е° – стандартный потенциал электрода.
В результате процесса сила тока в цепи начнет возрастать и концентрация восстанавливающихся ионов у поверхности ртутной капли уменьшится. Однако за счет диффузии из массы раствора к поверхности капли доставляются новые порции ионов. Сила тока в цепи будет зависеть от скорости диффузии, которая пропорциональна разности концентраций в массе раствора (С0М) и в приэлектродном слое. Сила тока будет пропорциональна этой разности:
I= kM(cM0-cM).

Потенциал полуволны является качественной характеристикой иона и зависит от среды:
1.Природы и концентрации фонового электролита.
2.Наличие в растворе веществ, способных к комплексообразованию с определяемым ионом. Присутствие в исследуемом растворе лиганда смещает потенциал полуволны в отрицательную область, что позволяет создавать условия для определения нескольких компонентов в одном растворе без их предварительного разделения. Например, в 1 М КС1 ионы свинца (II) и таллия (I) имеют потенциалы полуволны, соответственно, –0,435 и –0,483 В и их раздельное определение неосуществимо. В 1 М NaОН потенциал полуволны свинца становится равным –0,755 В, а у таллия остается практически без изменения.
Если в растворе находится несколько веществ, потенциалы полуволны которых различаются на 100 мВ и больше, то на полярограмме будет не одна волна, а несколько – по числу восстанавливающихся ионов, а возможно и больше, так как при ступенчатом восстановлении один ион может давать две.
Для идентификации неизвестного вещества можно этим методом определить потенциал полуволны и, пользуясь таблицей потенциалов полуволны или полярографическим спектром, установить наиболее вероятный элемент.

Анализируемый раствор находится в электролизере, на дне которого имеется слой ртути являющийся анодом. Часто в качестве анода используют насыщенный каломельный электрод (НКЭ). Катодом служит ртутный капающий электрод, соединенный с резервуаром ртути. Внешнее напряжение, подаваемое на электроды, можно плавно менять с помощью реохорда или делителя напряжения и измерять при этом гальванометром силу тока, проходящего через раствор.
Дата добавления: 2015-09-07; просмотров: 282 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Электроды сравнения | | | Количественный полярографический анализ. |