
Читайте также:
|
В основе всех количественных расчётов в титриметрических методах анализа лежит закономерность: количество эквивалента определяемого вещества равно количеству эквивалента титранта
n(fэкв1В1) _ n(fэкв2 B2 )
Все остальные расчётные формулы получают в зависимости от того, что хотят рассчитать - массу или массовую долю; каким методом проводят титрование - методом отдельных навесок или методом пипетирования и, наконец, как характеризуется количественный состав стандартного раствора титранта - с помощью молярной концентрации вещества, титра раствора, титра соответствия и т.д.
Согласно ИЮПАК эквивалентом называется реальная или условная частица, которая в конкретной кислотно-основной реакции эквивалентна тем или иным образом одному протону или в конкретной окислительно-восстановительной реакции одному электрону.
Таким образом, эквивалент - это не масса и не количество вещества.
Эквивалент - это частица!
Понятие «эквивалент» можно применять только к конкретной реакции. Нельзя говорить об эквиваленте вещества вообще.
| эквивалент |
| © |
1 протон
H2SO4 + NaOH ^ NaHSO4 + H2O
h2SQJ = □
2 протона
H2SO4 + 2NaOH ^ Na2SO4 + 2H2O
H2SOJ = ^
эквивалент = 1/2 H2SO4
Коэффициент, показывающий какая часть участвующей в реакции частицы эквивалентна одному протону или одному электрону, называется фактором эквивалентности (f^). Величина обратная фактору эквивалентности называется эквивалентным числом (z). Для реакции О f^ = z = 1, для реакции © f^ = У2, а z = 2.
Аналогично понятиям «количество вещества» и «молярная масса» существуют понятия «количество эквивалента вещества» и «молярная масса эквивалента вещества». Например, в реакции © i моль молекул серной кислоты соответствует 2 моль «половинок молекул» серной кислоты, а M(1/2 H2SO4) = 49 г/моль.
Понятие «эквивалент» отнюдь не является «священной коровой» в химии, а используется всего лишь для облегчения расчётов, так как позволяет проводить их без использования стехиометрических коэффициентов в уравнении соответствующей реакции. Для веществ, у которых формульная единица и эквивалент равны между собой (например, HCl или NaOH при кислотно-основном взаимодействии), лучше вообще не пользоваться понятием эквивалента.
Пусть нам необходимо найти массовую долю вещества ю(В),% имеющего молярную массу М(В), г/моль, в некотором анализируемом объекте, имеющем массу g, г. Для титрования используют раствор с молярной концентрацией эквивалента титранта C(fэквтВт). Для титрования израсходовано V', мл этого раствора.
m=mffi. 100% g
| эквивалента |
m(B) = n(f экв В) • f экв • М(В) n(f экв В) = C(f эквт В т) • V' • 10 -3

|
С помощью полученной формулы можно рассчитать массовую долю вещества в анализируемом объекте в случае использования прямого титрования (либо титрования заместителя или косвенного) по методу отдельных навесок. Если используют метод обратного титрования, то вместо С(Гзквт В t)Vt берут разность таких произведений
для двух титрантов /ОДквтВТ) • VT - ОД'квтВТ) • VT /. При проведении анализа методом пипетирования в расчётную формулу вводят множитель, называемый фактором разбавления (V / V). Он показывает, какая часть раствора, приготовленного из навески, используется для титрования (т.е. составляет аликвоту). Если заранее рассчитана величина титра соответствия, представляющая собой произведе-
—з
ние C(fэквт В т) • ^кв • М(В) • 10, то расчётная формула будет иметь следующий вид:
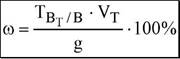
|
Пример 12.2. Навеску массой 1,9500 г образца глазной мази, содержащей HgO, поместили в делительную воронку и растворили мазевую основу в 10 мл диэтилового эфира. К образовавшейся смеси прибавили раствор KI, а затем 10,00 мл 0,1045 М HCl. Для титрования избытка кислоты потребовалось 7,00 мл 0,0998 М NaOH. Рассчитайте массовую долю HgO в анализируемом образце.
Методика определения HgO в глазной мази сочетает в себе титрование заместителя и обратное титрование. При взаимодействии HgO и KI выделяются OH- ионы, которые затем определяют обратным титрованием. Реакция между HgO и KI протекает следующим образом:
HgO + 4KI + H2O ^ K2[HgI4] + 2KOH
,тт ^ (10,00 • 0,1045 — 7,00 • 0,0998) • 10 —3 • 216,6 • 1/2 • 100
ra(HgO) = —--------------------------------- ------------------------------ = 1,92%
1,9500
Дата добавления: 2015-09-07; просмотров: 191 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Молярная | | | Для стандартизации растворов кислот для стандартизации растворов щелочей |