
Читайте также:
|
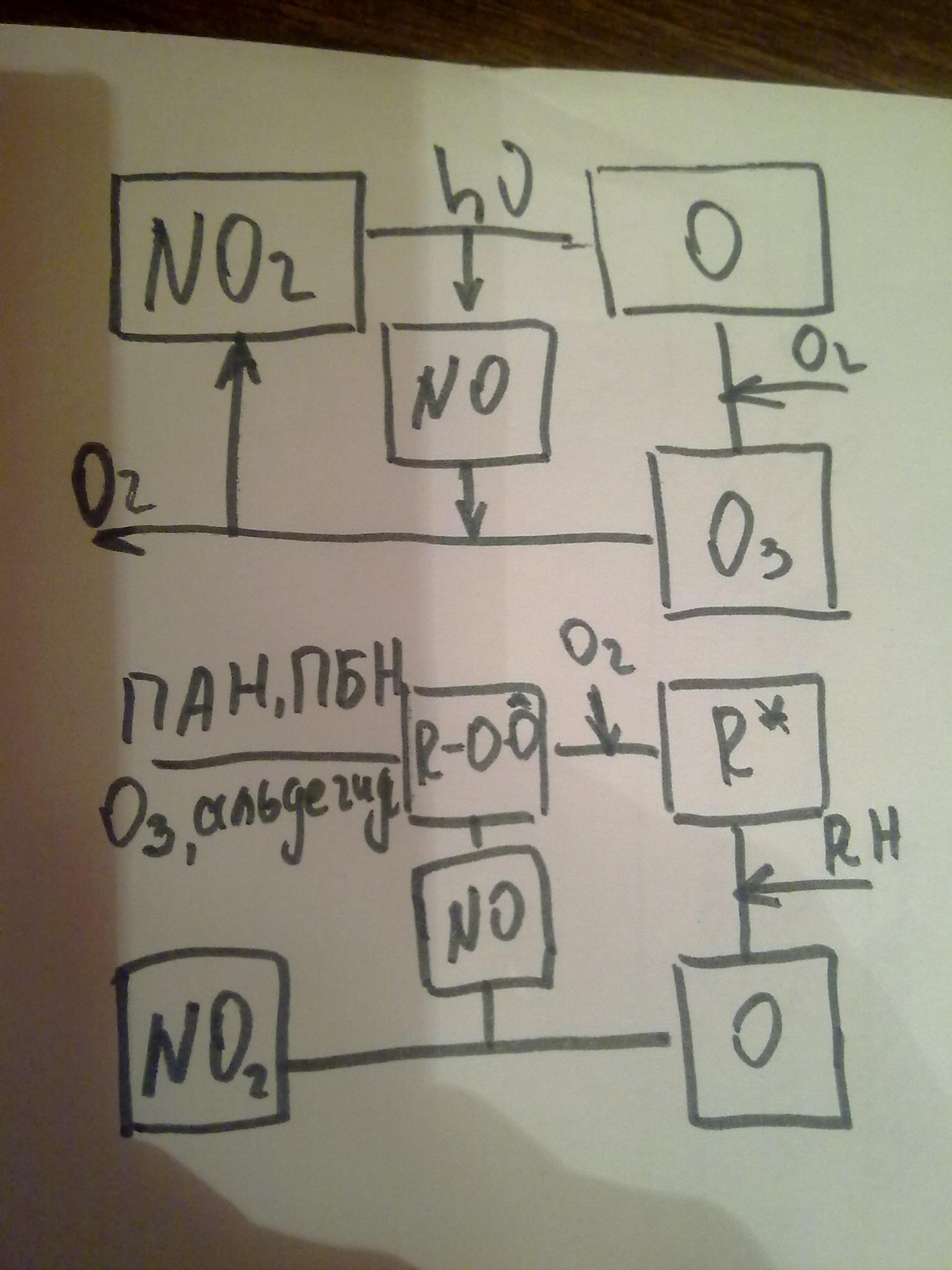
До 20 века: NO2а)→(hυ) O-→ (O2) O3; б) →(hυ) NO → (O3) NO2+ O2
После 20 века: NO2а)→(hυ) O-→ (R-H; ROO-) R-→(O2)ROO-→(O-)O3; б) →(hυ) NO→ (ROO-)ПАН (пироксиацетилнитрат), ПБН (пироксибензилнитрат).
24. Круговорот веществ в природе. Атмосферный цикл соединений серы.
В атмосфере соединения серы претерпевают целый ряд превращений (см рисунок ниже). Сероводород последовательно, в ряд ступеней, окисляется до диоксида серы, который, в свою очередь, тоже окисляется до серного ангидрида в результате фотохимического и радикального механизмов его взаимодействия с компонентами атмосферы, причем эти процессы существенно ускоряются в присутствии оксидов азота или углеводородов, а также оксидов железа, алюминия, хрома и других металлов. Атмосферная влага тоже способствует окислению диоксида в триоксид: в дождливую или туманную погоду время существования атмосферного диоксида серы не превышает 50 - 60 мин.
Атмосферный цикл соединений серы.

| ||||
|
Триоксид серы легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты. Реагируя с аммиаком или ионами металлов, присутствующими в атмосферной влаге, серная кислота частично переходит в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция. Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, взвешенных в воздухе. Образовавшиеся сульфаты сохраняются в атмосфере не более 5 дней.
Значительная часть соединений серы оседает на землю с атмосферными осадками. Таким образом, из атмосферы сера снова попадает в гидросферу и в почву.
25. Климат и состав атмосферы. Особая роль СО2. Парниковый эффект и потепление климата. Аэрозоли и климат.
Парниковый эффект и потепление климата. Парниковые газы: СО2, СН4, N2O, ИК-лучи. При увеличении концентрации этих газов на 0,06%, то темп. Повышается на 2-3°С. С увеличением конц. СО2 увеличивается темп. Земли, что приводит к образованию аэрозолей. Солнечная энергия не доходит до земли, т.е. образ. аэрозолей приводит к снижению температуры.
С повышением температуры, повышается растворимость тв. и жидких в-в в мировом океане, но снижается растворимость газов (выделяется СО2).

26.Особенности воды как растворителя. Карбонатные системы и концентрация ионов водорода в воде. Угольная кислота и рН раствора. Диаграмма Бьеррума.
Самая удивительная особенность воды - ее способность растворять другие вещества. Способность веществ к растворению зависит от их диэлектрической постоянной. Чем она выше, тем больше способно вещество растворять другие. Так вот, для воды эта величина выше, чем для воздуха или вакуума в 9 раз. Поэтому пресные или чистые воды практически не встречаются в природе. В земной воде всегда что-то растворено. Это могут быть газы, молекулы или ионы химических элементов. Считается, что в водах Мирового океана могут быть растворены все элементы таблицы периодической системы элементов, по крайней мере, на сегодня их обнаружено более 80. Свойства воды как растворителя во многом определяются поляризованным строением ее молекулы. Высокая полярность молекул является причиной активности воды при химических взаимодействиях, при растворении в ней солей, кислот и оснований, т. е. при образовании электролитов. Вода способна растворять многие вещества, создавая с ними однородные физико-химические системы переменного состава. Растворенные в природных водах соли находятся в ионном состоянии, т. е. подвергнуты электролитической диссоциации.
Растворяясь в воде, углекислый газ лишь частично вступает с ней во взаимодействие с образованием угольной кислоты (около 1%).Отдельно определить содержание окиси углерода и угольной кислоты в воде достаточно трудно, а поэтому суммарную концентрацию этих компонентов принимают за концентрацию свободной угольной кислоты. И так как только незначительное количество растворенного в воде углекислого газа образует угольную кислоту, то расчет содержания свободной угольной кислоты ведется по двуокиси углерода СО2. И константу диссоциации угольной кислоты можно определить как истинную, если в расчет брать только ионы действительно образующейся угольной кислоты и только первую ступень диссоциации. Тогда эта константа будет равна 1,32*10-4. Но можно определять константу диссоциации угольной кислоты и при условии, что весь углекислый газ образует угольную кислоту, и эту константу называют кажущейся. Она равна 4,45*10-7.
Другой формой содержания угольной кислоты в воде являются гидрокарбонаты, образующиеся при диссоциации угольной кислоты по 1-ой ступени (Н2СОз «-» Н+ + НСОз-), а также при диссоциации гидрокарбонатных солей, образующихся в результате растворения карбонатных пород под действием угольной кислоты:
СаСО3 + СО2 + Н2О = Са+2 + 2НСО3-
Гидрокарбонаты — наиболее распространенная форма содержания угольной кислоты в природных водах при средних значениях рН. Они обуславливают щелочность воды и это нам прежде всего необходимо помнить.
Еще угольная кислота может содержаться в карбонат-ионах (СОз2-), образующихся при диссоциации угольной кислоты по 2-й ступени:
НСОз- <-> Н+ + СОз2-.
Карбонат-ионы содержатся только в щелочной среде (при рН>8,4).

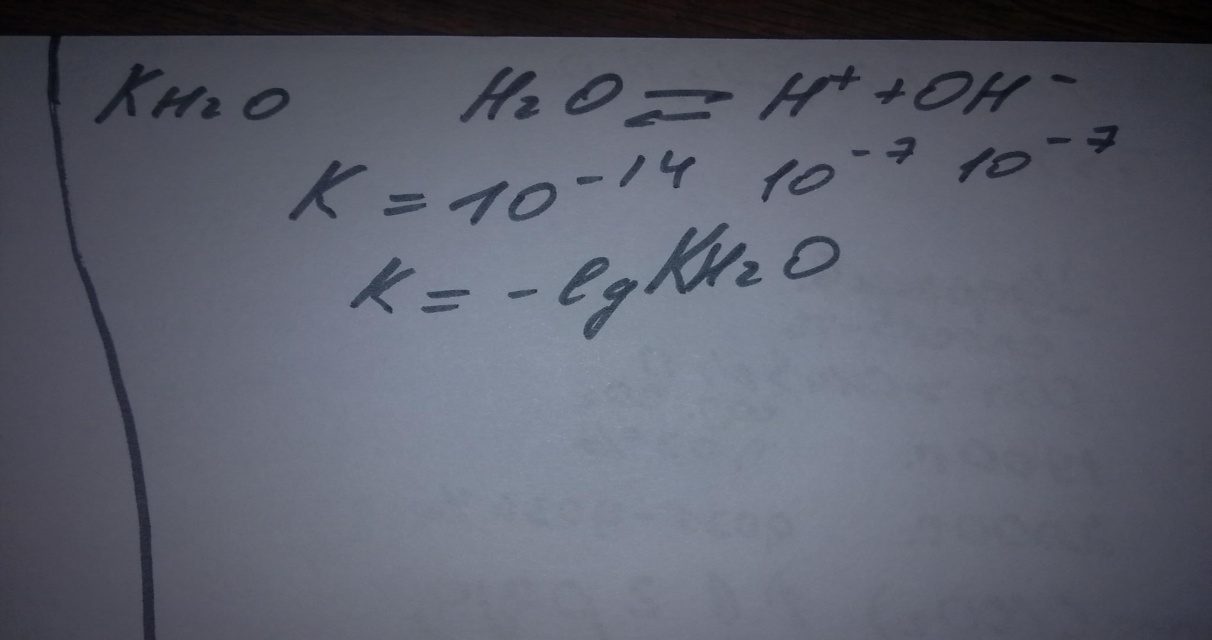
Диаграмма Бьеррума

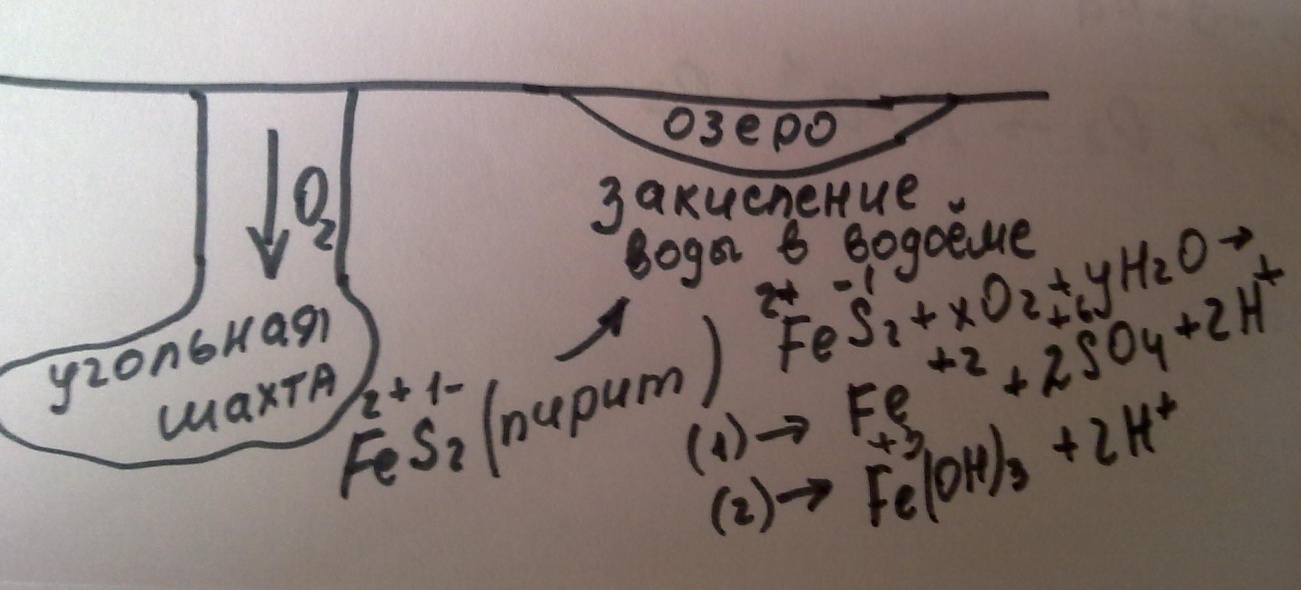
27.Кислотно-основные равновесия в природе. Растворимость карбонатных пород. Кальцит. Доломит. Закисление природных вод.
Кальцит — минерал CaCO3 из группы карбонатов, одна из природных форм карбоната кальция. Кальцит легко выщелачивается водами, богатыми углекислотой. Благодаря этому его свойству в районах залегания известняковых пород развивается карст и образуются пещеры.
При нагревании до 470 °C или при повышенном давлении превращается в арагонит. При дальнейшем нагревании кальцит разлагается с образованием углекислого газа и извести.
Доломит. минерал класса карбонатов, CaMg (CO3)2.

Процесс закисления поверхностных вод состоит из трех фаз.
1. Убыль ионов гидрокарбоната, т.е. уменьшение способности к нейтрализации при неизменяющемся значении рН.
2. Уменьшение рН при уменьшении количества ионов гидрокарбоната. Значение рН тогда падает ниже 5, 5. Наиболее чувствительные виды живых организмов начинают погибать уже при рН = 6, 5 (рис. 25).
3. При рН = 4, 5 кислотность раствора стабилизируется. В этих условиях кислотность раствора регулируется реакцией гидролиза соединений алюминия. В такой среде способны жить только немногие виды насекомых, растительный и животный планктон, а также белые водоросли.
Многие виды животных и растений начинают гибнуть уже при зачениях рН < 6. При рН < 5 не обеспечиваются условия для нормальной жизни (по данным SNV).
Дата добавления: 2015-09-06; просмотров: 487 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Юлия Варшавская | | | ИНСТРУКЦИЯ |