
Читайте также:
|
Окружающие нас разнообразные вещества состоят из атомов, скрепленных, как говорят, химическими связями. Еще более разнообразные химические превращения различных веществ обусловлены разрывом одних и образованием других, как правило, более прочных связей. Принципиально, что только квантовая механика смогла объяснить и количественно определить химическую связь как вид взаимодействия атомов, который обусловлен совместным использованием их электронов.
2.5. Расчет энергии и волновой функции молекулярного иона Н2+ вариационным вариантом метода МО ЛКАО
Основанная на квантовых законах теория простейшей молекулы Н2+ служит исходным пунктом для теории химической связи более сложных молекул, в той же степени, как теория водородоподобных атомов – для теории многоэлектронных атомов.

 
| Молекулярная орбиталь (МО) электрона e в поле двух протонов 1 и 2, находящихся на расстоянии R, представляется в виде линейной комбинации атомных орбиталей (ЛКАО):
 (2.5)
где (2.5)
где  - орбитали атомов водорода в основном 1 s состоянии; a 0 – радиус первой орбиты Бора. - орбитали атомов водорода в основном 1 s состоянии; a 0 – радиус первой орбиты Бора.
|
Искомые “весовые“ коэффициенты c 1 и c 2согласно вариационномуметоду находятся из условия минимума энергии системы
 (2.6)
(2.6)
где 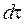 - элемент объема, по которому производится интегрирование, знак комплексного сопряжения (*) для действительных функций может быть опущен. Оператор Гамильтона для молекулярного иона имеет вид:
- элемент объема, по которому производится интегрирование, знак комплексного сопряжения (*) для действительных функций может быть опущен. Оператор Гамильтона для молекулярного иона имеет вид:
 . (2.6’)
. (2.6’)
Алгебраически преобразуя числитель и знаменатель (2.6), получаем
 (2.7)
(2.7)
где  (2.7’)
(2.7’)  . (2.7”)
. (2.7”)
Необходимые условия минимума энергии после выполнения соответствующих математических действий приводят к однородной системе двух линейных уравнений:
 (2.8)
(2.8)
Для совместности уравнений необходимо, чтобы “вековой” определитель системы был равен нулю.
 . (2.9)
. (2.9)
Вторая в строке (2.9) - сокращенная запись обобщающего определителя n -го порядка принципиально определяет решение для волновой функции из n атомных орбиталей.
Для нормированных 1 s -орбиталей  а единственный интеграл их перекрывания
а единственный интеграл их перекрывания  (см. (2.7”)).
(см. (2.7”)).
Входящие в (2.9) энергетические матричные элементы (2.7’) получили название кулоновского интеграла:  . С учетом (2.6’) он включает атомную составляющую (-1/2), энергию взаимодействия электрона со вторым протоном и кулоновское отталкивание ядер. Два оставшихся матричных элемента (2.7’)
. С учетом (2.6’) он включает атомную составляющую (-1/2), энергию взаимодействия электрона со вторым протоном и кулоновское отталкивание ядер. Два оставшихся матричных элемента (2.7’)  назвали обменным интегралом, именно он фактически и определяет энергию химической связи (см. ниже).
назвали обменным интегралом, именно он фактически и определяет энергию химической связи (см. ниже).
Определитель (2.9) и вытекающее из него квадратное уравнение имеет два решения


Подстановка этих энергий в (2.8) для определения с 1 и с 2 дают соответственно симметричную и антисимметричную (*) молекулярные орбитали:


| ||
| Рис. 2.3. Потенциальные кривые и энергетические уровни связывающего и отталквательного состояния Н2+ (а). Энергетические уровни без учета интеграла перекрывания (б). | ||

| Рис. 2.4. Схема и заселенности МО молекул и радикалов, образованных атомами элементов 1-го периода. | |

| Рис. 2.5. Схематическое изображение образования связывающей σ1 s и разрыхляющей σ*1 s МО. |
Основные следствия:
1. Знаки исходных АО имеют смысл только в процедуре образования МО. Переход от области “+“ к области “-“ в разрыхляющей антисимметричной МО соответствует т.н. узловой точке с нулевой вероятностью нахождения электрона между ядрами. Для определяющей химическую связь симметричной МО характерно увеличение электронной плотности между ядрами.
2. Расположение энергетических уровней (2.9) и (2.9*) на рис. 2.3 показывают, что электрон на разрыхляющей орбитали разрыхляет связь сильнее, чем укрепляет ее электрон на связывающей.
3.Энергия диссоциации молекулы при разрыве химической связи преимущественно определяется обменным интегралом

Дата добавления: 2015-09-02; просмотров: 47 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Бросьте всё: займите денег, продайте мебель, возьмите отпуск, если вас не отпускают с работы, но участвуйте. | | | Многоэлектронные молекулярные системы |