
|
Читайте также: |
ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА РЕАЛЬНОГО ГАЗА
Цель работы: изучить зависимость давления реального газа от объема при постоянной температуре, определить упругость насыщенного пара.
Оборудование: стеклянная трубка с исследуемым веществом, манометр, насос.
Описание метода
Газы не идеальны. При сравнительно высоких давлениях и низких температурах их состояние не подчиняется уравнению Менделеева–Клапейрона. Из большого числа уравнений состояния реальных газов уравнение Ван-дер-Ваальса отличается тем, что оно описывает переход газа в жидкое состояние и что поправки, введенные в уравнение состояния идеального газа Менделеева–Клапейрона, имеют физический смысл. Для одного моля оно имеет вид
 , (1)
, (1)
где  – учет собственного объема молекул,
– учет собственного объема молекул, 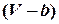 – объем, доступный для движения молекул;
– объем, доступный для движения молекул; 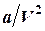 – добавочное давление, обусловленное взаимным притяжением молекул. Слой молекул около стенки сосуда притягивается к внутренним молекулам под действием сил Ван-дер-Ваальса. В результате давление в газе выше, чем на стенку. Сила добавочного давления пропорциональна произведению числа молекул
– добавочное давление, обусловленное взаимным притяжением молекул. Слой молекул около стенки сосуда притягивается к внутренним молекулам под действием сил Ван-дер-Ваальса. В результате давление в газе выше, чем на стенку. Сила добавочного давления пропорциональна произведению числа молекул  (или их концентрации
(или их концентрации  ) у поверхности и внутри газа. Так как
) у поверхности и внутри газа. Так как  , то добавочное давление обратно пропорционально квадрату объема газа.
, то добавочное давление обратно пропорционально квадрату объема газа.
 Изотермы Ван-дер-Ваальса представлены на
Изотермы Ван-дер-Ваальса представлены на  -диаграмме (рис. 1). Среди них есть особая изотерма при температуре, равной так называемой критической
-диаграмме (рис. 1). Среди них есть особая изотерма при температуре, равной так называемой критической  . Если
. Если  , то сжатием газ нельзя перевести в жидкое состояние. В этой области состояние газа удовлетворительно описывается уравнением Менделеева–Клапейрона.
, то сжатием газ нельзя перевести в жидкое состояние. В этой области состояние газа удовлетворительно описывается уравнением Менделеева–Клапейрона.
При температурах меньше критической  газ из состояния ненасыщенного пара можно сжатием перевести в жидкое состояние. По мере уменьшения объема (рис. 1) давление пара вначале возрастает и при давлении, равном упругости насыщенного пара
газ из состояния ненасыщенного пара можно сжатием перевести в жидкое состояние. По мере уменьшения объема (рис. 1) давление пара вначале возрастает и при давлении, равном упругости насыщенного пара  начинается конденсация (рис. 1, т. А).
начинается конденсация (рис. 1, т. А).
Обычно  -образная часть изотермы, соответствующая метастабильным состояниям перенасыщенного пара и перегретой жидкости, экспериментально не реализуется. Поэтому изотерма представляет собой горизонтальный участок, конденсация газа происходит при постоянном давлении
-образная часть изотермы, соответствующая метастабильным состояниям перенасыщенного пара и перегретой жидкости, экспериментально не реализуется. Поэтому изотерма представляет собой горизонтальный участок, конденсация газа происходит при постоянном давлении  . После полной конденсации (т. В) дальнейшее сжатие приводит к резкому повышению давления, так как жидкости мало сжимаемы.
. После полной конденсации (т. В) дальнейшее сжатие приводит к резкому повышению давления, так как жидкости мало сжимаемы.
Колоколообразная область на  -диаграмме (рис. 1) соответствует области совместного существования жидкости в равновесии со своим насыщенным паром. Вершина колоколообразной кривой соответствует особому состоянию вещества – критическому, при котором физические свойства жидкости и насыщенного пара одинаковы, между ними исчезает граница раздела, теплота парообразования равна нулю.
-диаграмме (рис. 1) соответствует области совместного существования жидкости в равновесии со своим насыщенным паром. Вершина колоколообразной кривой соответствует особому состоянию вещества – критическому, при котором физические свойства жидкости и насыщенного пара одинаковы, между ними исчезает граница раздела, теплота парообразования равна нулю.
Область на  -диаграмме слева от колоколообразной кривой и под критической изотермой соответствует жидкому состоянию, справа – состоянию ненасыщенного пара, а над критической изотермой – состоянию идеального газа.
-диаграмме слева от колоколообразной кривой и под критической изотермой соответствует жидкому состоянию, справа – состоянию ненасыщенного пара, а над критической изотермой – состоянию идеального газа.
В данной работе в качестве исследуемого вещества используется пентан С5Н10. Критическая температура пентана 196 °С и поэтому при комнатной температуре он может находиться как жидком, так и в газообразном состоянии в зависимости от давления.
Дата добавления: 2015-08-21; просмотров: 49 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Технические характеристики | | | Описание установки |