
Читайте также:
|
1. Гидролиз по аниону идет, если соль образована катионом сильного основания и анионом слабой кислоты (Na2CO3, K2S, Na3PO4, CH3COONa и пр.).
Пример 1. Соль СН3СООNa образована сильным основанием NaOH и слабой одноосновной кислотой СН3СООН. Гидролизу подвергается ион слабого электролита СН3СОО–.
Ионно-молекулярное уравнение гидролиза соли:
СН3СОО– + НОН «СН3СООН + ОН–
Ионы Н+ воды связываются с анионами СН3СОО– в слабый электролит СН3СООН, ионы ОН– накапливаются в растворе, создавая щелочную среду (рН>7).
Молекулярное уравнение гидролиза соли:
CH3COONa + H2O «CH3COOH + NaOH
Гидролиз солей многоосновных кислот протекает по стадиям, образуя в качестве промежуточных продуктов кислые соли.
Пример 2. Составление уравнения гидролиза соли Na2CO3
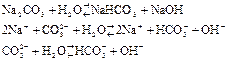
Пример 3. Соль K2S образована сильным основанием КОН и слабой двухосновной кислотой H2S. Гидролиз этой соли протекает в две стадии.
1 стадия: S2– + HOH «HS– + OH–
K2S + H2O «KHS + KOH
2 стадия: HS-– + HOH «H2S + OH–
KHS + H2O «H2S + KOH
Реакция среды щелочная (pH>7), т.к. в растворе накапливаются ОН–-ионы. Гидролиз соли идет тем сильнее, чем меньше константа диссоциации образующейся при гидролизе слабой кислоты. Таким образом, водные растворы солей, образованных сильным основанием и слабой кислотой, характеризуются щелочной реакцией среды.
2. Гидролиз по катиону идет, если соль образована катионом слабого основания и анионом сильной кислоты (FeCl3, CuSO4, BiCl3 и пр.).
Пример 4. Соль CuSO4 образована слабым двухкислотным основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием в качестве промежуточного продукта основной соли.
1 стадия: Cu2+ + HOH «CuOH+ + H+
2CuSO4 + 2H2O «(CuOH)2SO4 + H2SO4
2 стадия: CuOH+ + HOH «Cu(OH)2 + H+
(CuOH)2SO4 + 2H2O «2Cu(OH)2 + H2SO4
Ионы водорода Н+ накапливаются в растворе, создавая кислую среду (рН<7). Чем меньше константа диссоциации образующегося при гидролизе основания, тем сильнее идет гидролиз.
Таким образом, водные растворы солей, образованных слабым основанием и сильной кислотой, характеризуются кислой реакцией среды.
3. Гидролиз по катиону и аниону идет, если соль образована катионом слабого основания и анионом слабой кислоты.
Пример 5. Например, соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой СН3СООН. Гидролиз идет по катиону NH4+ и аниону СН3СОО–:
NH4+ + CH3COO– + HOH «NH4OH + CH3COOH
Водные растворы такого типа солей, в зависимости от степени диссоциации образующихся слабых электролитов имеют нейтральную, слабокислую или слабощелочную среду.
4. Соли, образованные катионами сильных оснований и анионами сильных кислот (NaCl, KNO3, Na2SO4 и пр.), гидролизу не подвергаются, так как ни один из ионов соли не образует с ионами Н+ и ОН– воды слабых электролитов. Водные растворы таких солей имеют нейтральную среду.
Дата добавления: 2015-08-21; просмотров: 251 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Порядок выполнения работы | | | Порядок выполнения работы |