
|
Читайте также: |
Иммобилизация ферментов - это повышение их стабильности. В биологических объектах ферменты находятся в фиксированном состоянии на поверхности различных клеточных структур и сохраняют активность в течение длительного времени. В то же время выделенные из органов и тканей или полученные из микробного сырья, особенно в высоко очищенном состоянии, они быстро инактивируются. Поэтому повседневное клиническое использование натнвных ферментов лимитируется прежде всего их высокой лабильностью к различным факторам окружающей среды (значение рН, температура и др.), быстрой инактивацией в организме и выделением из организма, что повышает расход ферментов, а также наличием антигенных свойств чужеродных организму белков. Перечисленные недостатки в значительной степени могут быть устранены при использовании ферментов в иммобилизованном виде.
При создании иммобилизованных ферментов, применяемых в медицине, определили два направления:
1) когда присутствие фермента необходимо в разных органах или он предназначен для длительной циркуляции в кровотоке, получают его стабилизированные водорастворимые формы. К этой группе могут быть отнесены и искусственные клетки, наполненные ферментами: микрокапсулы, липосомы и клетки крови;
2) при лечении очаговых заболеваний целесообразны иммобилизованные ферменты, которые могут быть локализованы в определенном месте организма и способны к его выделению с заданной скоростью в окружающую среду. Однако необходимость введения иммобилизованного фермента в организм отпадает, если он действует на субстрат, присутствующий в биологических жидкостях. В этих случаях используют системы экстракорпоральной перфузии, помещая иммобилизованный фермент в закрытую систему, через которую циркулирует биологическая жидкость (кровь, лимфа и др.), возвращающаяся в организм освобожденной от вредного метаболита.
Водорастворимые препараты иммобилизованных ферментов. Высокомолекулярные водорастворимые производные ферментов на данном этапе развития медицинской энзимологии являются их наиболее рациональными формами. Фермент и полимер, как правило, соединены ковалентной связью. Молекула фермента обволакивается макромолекулой полимера в результате образования между ними 6-10 ковалент-ных связей. Многоточечное взаимодействие фермента с носителем делает его конформацию более жесткой и менее подвижной. Фермент оказывается заключенным в полимерную оболочку, имеющую вид петель и достаточно хорошо проницаемую для высокомолекулярных субстратов. Поэтому такие соединения получили название «открытые» макромолекулярные капсулы. Водорастворимые полимерные производные ферментов характеризуются повышенной стабильностью in vitro и in vivo, увеличенным временем циркуляции в кровотоке, что обусловливает пролонгирование их действия в организме. Они оказывают менее выраженное побочное действие, что связано с пониженной по сравнению с нативными ферментами способностью стимулировать образование антител и реагировать с ними вследствие затруднений для специфического взаимодействия антиген - антитело.
Положительные качества ферментов, модифицированных водорастворимыми полимерами, открывают широкие перспективы для их клинического использования. Определенные успехи в этом направлении достигнуты при применении в клинике иммобилизованных протеаз в качестве фибринолитических и противовоспалительных препаратов. Особое значение в этой связи приобретают разработка и внедрение в клинику стрептодеказы.
Стрептодеказа для инъекций (Strep-toclecasum pro injectionibus) - первый препарат пролонгированного действия для тромболитической терапии, полученный на основе иммобилизованного фибри-нолизина (стрептокиназы) и разрешенный к медицинскому применению в 1981 г. Над созданием препарата работали коллективы ВНИИ ТИАФ, Всесоюзного кардиологического научного центра (ВКНЦ) АМН СССР и ИОС АН Латвии.
В качестве водорастворимого полимера-носителя для иммобилизации стрептокиназы использован дек-стран с м.м. 60 000, выпускаемый под названием полиглюкин. Предварительное активирование иоли-глюкина проводят калия периодатом при комнатной температуре и перемешивании раствора в течение 1 ч. Очистку окисленного полиглюкина от примесей осуществляют хроматографической адсорбцией.
Для иммобилизации стрептокиназы к ее раствору приливают раствор окисленного полиглюкина, имеющего значение рН 8,7, и перемешивают в течение 1 ч. Аминогруппы стрептокиназы и альдегидные группы окисленного полиглюкина взаимодействуют с образованием азометиловой связи. Затем реакционную смесь охлаждают до 4°С. Последующее восстановление стрептодеказы проводят при добавлении к реакционной массе натрия боргидрида и перемешивании в течение 1 ч при температуре 4°С. Азометиловые связи (-CH-N-) между полимером и белком восстанавливаются до Н2С-NH-связей, а избыток аль
I I
дегидных групп полимера (реакционные группы, оставшиеся после реакции) - до гидроксильных. После определения фибринолитической активности раствор концентрируют с помощью ультрафильтрации. Концентрат подвергают стерилизующей фильтрации и затем.сублимационной сушке.
Препарат представляет собой порошок или пористую массу белого цвета. Выпускают в герметически укупоренных флаконах вместимостью 10 мл, содержащих по 1 500 000 или 1 000 000 ФЕ (фибринодитиче-ских единиц) стрептодеказы (в пачках по 2 флакона). Хранят по списку Б, при температуре не выше 10°С. Стрептодеказу обычно в дозе 2 700 000 ФЕ (через 1 ч после пробной инъекции 300 000 ФЕ) вводят однократно, внутривенно, струйно, растворяя непосредственно перед применением в 20-50 мл изотонического раствора натрия хлорида. В этой дозе препарат вызывает значительное повышение фибриполнти-ческой активности крови и действует в течение 48-72 ч.
Включение ферментов в микрокапсулы. Микро-капсулирование ферментов состоит во включении их водных растворов в полупроницаемые мембраны толщиной около 20 им, непроницаемые для ВМС и клеток, но через которые могут проникать низко-молекулярные вещества. Наличие ультратонкой мембраны позволяет создать высокие концентрации фермента в малых объемах раствора, находящегося в микрокапсуле, и сохранять стабильность и биологическую активность инкапсулированных ферментов. Использование фермента в высоких концентрациях, а также большие значения отношения площади поверхности микрокапсул к их объему обеспечивают быструю диффузию низкомолекулярного субстрата из внешней среды к ферменту и продукта реакции из внутреннего объема микрокапсулы в межкапсулярное пространство.
Получены и исследованы микрокапсулнрованные формы ряда ферментов, катализирующих различные превращения ннзкомолекулярных субстратов. Так, микрокапсулированная каталаза, введенная внутривенно или внутрмбрюшпнно мышам с наследственным нарушением синтеза этого фермента, эффективно снижала содержание перборатов в крови и имела более длительный период жизни в организме, чем свободный фермент. Микрокапсулированная аспара-гиназа, введенная мышам с аспарагинзависимыми опухолями, вызывала стойкое и длительное снижение аспарагина в крови, что препятствовало росту злокачественных новообразований. Микрокапсулированная уреаза после введения крысам в желудочно-кишечный тракт вызывала существенное понижение содержания мочевины в крови. Следует отметить, что все исследования микрокапсул и рованных ферментов проводятся только на животных. Это связано с тем, что при иитракорпоральном их введении материал, используемый для создания мембран, накапливается в основном в селезенке и печени и может быть далеко не безразличен для организма.
Идеальным материалом с точки зрения биологической утилизации микрокапсул в организме человека и животных могут быть различные природные мембраны клеток крови. Фермент при относительно мягких условиях (нейтральная среда, небольшая ионная сила и т.д.) может быть заключен в частично гемоли-зованные клетки крови (эритроциты, тромбоциты) с последующим восстановлением целостности их мембран. Поскольку размер ферментных элементов крови мал, а время жизни их в кровяном русле относительно велико, такие микрокапсулы могут беспрепятственно и длительно циркулировать в крови. В форменные элементы крови включены такие ферменты, как |3-глю-козидаза, Р-галактозидаза, а-амилаза, пероксидаза, аргиназа, аспарагиназа и некоторые другие. Все иммобилизованные в клетки крови ферменты имеют неизменяемые каталитические параметры п отличаются большей устойчивостью к повышению температуры.
Применение микрокапсул, содержащих ферменты, экстракорпорально через шунты или камеры имеет хорошую перспективу. Одно из преимуществ состоит в том, что не происходит контакта фермента с им м у некомпетентным и клетками, тем самым исключается возмодность сенсибилизации организма со всеми неблагоприятными последствиями. Кроме того, применение вне организма исключает накопление в нем искусственных клеток и снимает проблему разрушения и утилизации полимерных материалов. Благодаря ультратонкой полупроницаемой мембране и высоким значениям отношения площади поверхности микрокапсул к их объему, скорость диффузии низкомолекулярных веществ через микрокапсулы выше, чем через диализную мембрану в аппарате искусственная почка. Принцип энзиматического превращения вредных метаболитов с помощью микрокапсулирован-ных ферментов разрабатывается для применения в аппаратах искусственная почка и искусственная печень. Перспективным может оказаться использование микрокапсулированных ферментов для удаления мочевины - одного из самых токсичных метаболитов клетки. Одним из способов является превращение мочевины под действием микрокапсулированной уреа-зы в аммоний и углерода диоксид. Вторым - использование экстракорпорального шунта, снабженного микрокапсулами с мультиферментными рециклиру-ющими комплексами. С помощью таких микрокапсул, благодаря сложной цепи рециклирующих реакций, мочевина и аммоний превращаются в аминокислоты: глутамат, оксиглутарат, аланин.
Включение ферментов в липосомы. Лнпосомы - биелойные сферические образования с водной фазой внутри и размером несколько сотен ангстрем или полибислойные образования, состоящие из нескольких концентрических бислоев с внутренней полостью и размером до многих сотен ангстрем и даже до 1 мкм. Для получения липосом ферменты или другие биологически активные вещества в водных растворах подвергают ультразвуковой обработке в присутствии положительно или отрицательно заряженных фосфо-липидов.
Липосомы после разрушения составляющих их фосфолипидов могут быть утилизированы как компоненты клеточных мембран. Кроме того, они дают уникальную возможность введения фермента внутрь клеток, с которыми взаимодействуют. В зависимости от физических параметров фосфолипидов (заряд, жидкость, размер) липосомы проникают в клетку посредством эндоцитоза или за счет слияния с природными мембранами. При эндоцитозе липидная оболочка липосом внутри клеток разрушается фосфо-липазами лизосом и лекарственное вещество освобождается в цитоплазму; при слиянии с клеточной мембраной липидиый компонент липосом входит в состав клеточных мембран, а его лекарственное содержимое поступает в цитоплазму.
Распределение липосом по различным органам при их введении животным детально изучено. Основная их часть (от 50 до 80%) поглощается клетками ре-тикулоэндотелиальной системы, в первую очередь находящимися в печени и селезенке. Свойство липосом избирательно-концентрироваться в клетках ретикуло-эндотелиадьной системы использовано для лечения генетически обусловленных нарушений синтеза и функционирования лизосомальных гидролаз печени. При этом следует отметить, что пораженная печень накапливает в несколько раз больше липосом, чем здоровая. При лечении ферментом, включенным в липосомы, больного с дефицитом лизосомальной а-глкжо-зидазы, сопровождающимся усиленным накоплением гликогена в печени, наблюдали быстрое (в течение недели) снижение уровня гликогена и уменьшение размера печени. Положительный терапевтический эффект на людях отмечен при использовании включенной в липосомы глюкоцереброзидазы при болезни Гоше, связанной с нарушением метаболизма глюко-цереброзидов, накапливающихся в клетках ретикуло-эндотелиальной системы в результате дефицита соответствующего лизосомального фермента.
Направленность действия лилосом (органотроп-ность) может быть изменена при изменении состава компонентов, образующих мембрану, а сродство ли-посом к клеткам-мишеням усилено с помощью специфических факторов (антитела, лектины и др.).
Препараты иммобилизованных ферментов, применяемые при локальных заболеваниях. При локальных заболеваниях целесообразно использование иммобилизованных ферментов, которые могут быть локализованы в определенном месте организма и способны к постепенному выделению в окружающую среду. При получении таблеток и гранул ферментных препаратов (трипсина, лизоцима, щелочной фосфатазы, ка-талазы и др.) предложено вводить их в смеси с биосовместимыми полимерами (полиакриламидом, поли-впнилпирролидоном, спиртом поливиниловым и др.). Имплантированный в очаге поражения или поблизости от него находящийся в полимере фермент практически полностью защищен от воздействия агрессивной физиологической среды. Вместе с тем из полимера фермент выходит в нативном состоянии и скорость его последующей инактивации и выведения, как и вызываемые им токсические, аллергические и иммунные реакции, та же, что и для нативного фермента, применяемого традиционным способом.
Перспективны рассасывающиеся в организме фер-ментосодержащие препараты, которые с помощью катетеризации могут вводиться непосредственно в мышечную ткань или капиллярную сеть пораженного органа и поддерживать там высокую локальную концентрацию стабилизированного фермента.
В качестве полимерного носителя использовали сефадекс, который предварительно окисляли кислотой йодной или натрия перйодатом. Полученные при окислении альдегидосефадексы способны к медленному растворению. Изменение степени окисления позволяет варьировать их растворимость в самых широких пределах. Иммобилизованный на таком носителе фермент переходит в раствор ковалентно связанным с осколком (фрагментом) носителя, который не только дополнительно его стабилизирует, но и уменьшает вызываемые ферментом нежелательные реакции организма.
Иммобилизованные на частично окисленных полисахаридах тромболитические фермент ы показали большую перспективность для терапии тромбозов. Лизис тромба достигается меньшей дозой иммобилизованного фермента, депонируемого непосредственно в месте расположения тромба методом катетеризации.
К биодеградируемым препаратам могут быть отнесены ферменты, иммобилизованные в структуре полимерных волокон и пленок в процессе их формирования. Различают обычные и полые волокна. Для получения обычных волокон к раствору полимера (триацетатцеллюлоза, нитроцеллюлоза, этил целлюлоза, поливинилхлорид и др.) в органическом растворителе добавляют водный раствор или суспензию фермента. Смесь эмульгируют и продавливают через мелкое сито в коагулируемую жидкость. Образующиеся волокна представляют собой полимерные гели, которые содержат в структуре водный раствор фермента. Полые волокна изготавливают из природных или синтетических полимеров, таких как целлюлоза, поливинилхлорид, полисульфон, полиакрил амид, нейлон. Полые волокна состоят из основной массы полимерной матрицы, которая имеет внутреннюю полую область, заполненную раствором фермента. Он удерживается в полой области волокна за счет физической иммобилизации или химической связи между аминогруппами фермента н активными группами, находящимися на внутренней поверхности волокна. Каталитические свойства ферментов, включенных в волокна, используются в медицине в экстракорпоральных шунтах для детоксикации организма при различных патологических состояниях и в терапии субстрат-зависимых опухолей, а также в ферментативных реакторах при диагностических определениях концентрации метаболитов в крови. Так, уреаза, включенная в волокна из триацетатцеллюлозы, химически сшитая с помощью глутарового альдегида с нейлоновыми трубками, эффективно снижала уровень мочевины в крови животных. Уреаза, иммобилизованная на нейлоновых трубках, оказала положительный терапевтический эффект при лечении больных, страдающих гиперуриксмией, обеспечив быстрое удаление уратов из кровяного русла. Подсоединение экстракорпоральных шунтов, содержащих аспарагиназу, включенную в волокла из трнацетатцеллюлозы и дакрона или ко-валентно пришитую за счет глутарового альдегида к внутренней поверхности нейлоновых трубок, приводило к полному удалению аспарагина из кровяного русла животных.
Протеолитические ферменты, включенные в систему нерастворимых (фторопласт-42 и др.) и растворимых (ПВС и др.) в воде полимеров, используются при гнойных ранах. Фермент выделяется благодаря диффузии или постепенному растворению пленки. Применение полимерных пленок ускоряет очищение ран в 3-4 раза, расход фермента на курс лечения снижается приблизительно в 20 раз.
Контрольные вопросы
1. Перечислите ферментные препараты, получаемые из микроорганизмов.
2. Объясните особенности выделения внеклеточных и внутриклеточных ферментов из микроорганизмов.
3. Укажите способы иммобилизации, наиболее рациональные для ферментов.
4. Назовите особе!!ности биодеградируемых ферментных препаратов.
5. Как получают стрептодеказу? В какой лекарственной форме ее выпускают? Как применяют?
Глава 20
СУСПЕНЗИИ И ЭМУЛЬСИИ (SUSPENSIONES ЕТ EMULSA)
Определение лекарственных форм - суспензии и эмульсии как систем гетерогенных, механизм стабилизирующего действия ВМС и ПАВ, их классификацию и характеристику см. том 1.
В данной главе найдут отражение особенности промышленного производства суспензий и эмульсий.
Производство суспензий и эмульсий. Получение суспензий и эмульсий на крупных фармацевтических предприятиях осуществляется разными способами: интенсивным механическим перемешиванием с помощью быстроходных мешалок и РПА; размолом твердой фазы в жидкой среде на коллоидных мельницах, ультразвуковым диспергированием с использованием магнитострикционных и электрострикцион-ных излучателей. Микрокристаллические взвеси получают также конденсационным способом, направленной кристаллизацией при смешивании растворов в определенных условиях температурного режима, характера перемешивания, значения рН среды и т. д.
Твердое вещество предварительно измельчают до мелкодисперсного состояния на специальных машинах, готовят концентрированную суспензию перемешиванием в смесителях, затем многократно диспергируют на коллоидных мельницах или на ультразвуковых и других установках. Для «сухих» суспензий, представляющих собой смесь лекарственного и вспомогательных веществ, образующих взвесь после добавления воды (в аптеке или домашних условиях), каждый ингредиент измельчают отдельно и просеивают через тонкое сито. После смешивания ингредиентов во избежание расслоения смесь вновь просеивают. Полученную готовую продукцию подвергают анализу в соответствии с требованиями НТД, стандартизуют и фасуют.
Для механического диспергирования применяют пропеллерные и турбинные мешалки закрытого и открытого типов. Пропеллерные мешалки создают круговое и осевое движение жидкости со скоростью 160- 1800 об/мин и применяются для маловязких систем. В процессе перемешивания часто используют вакуум для удаления пузырьков воздуха, которые понижают устойчивость системы. Более мелко диспергированные и стойкие суспензии и эмульсии можно получить с помощью турбинной мешалки, создающей турбулентное движение жидкости. Мешалки открытого типа представляют собой турбинки (рис. 20.1, а, б) с прямыми, наклонными под разными углами или криволинейными лопастями.
Мешалки закрытого типа - это турбинки, установленные внутри неподвижного кольца с лопастями, изогнутыми под углом 45-90° (рис. 20.1, в). Жидкость входит в мешалку в основании турбинки, где расположены круглые отверстия, и под действием центробежной силы выбрасывается из нее через прорези между лопастями кольца, интенсивно перемешиваясь во всем объеме реактора. Скорость вращения турбинки 1000-7000 об/мин.

Рис. 20.1. Устройство турбинных мешалок, а, б - открытого; в - закрытого типа.

Рис. 20.2. Устройство РПА проточного типа.
1 - приводной вал; 2 -- рогор; 3 - патрубок выхода суспензии, 4 - крышка-статор; 5 - патрубок л хода.
В промышленной технологии суспензионных и эмульсионных препаратов широкое распространение нашли РПА. При получении дисперсных систем РПА могут быть непосредственно погруженными в реактор с перемешиваемой средой, иногда в дополнение к имеющейся в нем мешалке. РПА погружного типа имеют ротор и статор с концентрически расположенными на них зубцами или цилиндрами с отверстиями и по форме напоминают мешалки. РПА проточного типа устанавливается вис реактора (рис. 20.2). Ротор и статор его заключены в корпус, имеющий входной и выходной патрубки. Обрабатываемая смесь поступает по осевому патрубку внутрь аппарата и под действием центробежной силы выбрасывается через выходной патрубок. Движение жидкости в аппарате осуществляется от центра к периферии. Существуют РПА, в которых движение обрабатываемой среды имеет противоположное направление, от периферии к центру, и диспергированная жидкость выходит через осевой патрубок.
В процессе работы РПА развиваются интенсивные механические воздействия на частицы дисперсной фазы, вызывающие турбулизацию и пульсацию смеси. Для повышения эффективности диспергирования разработаны конструкции РПА с раздельной подачей компонентов обрабатываемой среды по специальным каналам в теле статора, с дополнительными рабочими элементами в виде лопастей на роторе или статоре, с диспергирующими телами (шары, бисер, кольца), свободно размещенными в полостях ротора, с роликовыми подшипниками в обоймах. Диспергирование в РПА такого типа происходит за счет соударения свободно размещенных тел с вращающимися и неподвижными элементами, а также путем раздавливания и истирания материала в местах контакта роликов с вращающимися и неподвижными обоймами. Распространены РПА с рифлеными поверхностями рабочих частей с различного рода зазорами между ними. Чем меньше зазор между вращающимися и неподвижными цилиндрами, тем выше степень дисперсности. Наиболее приемлем для получения мелко измельченных дисперсий радиальный зазор в 0,15- 0,3 мм.

Рис. 20.3. Устройство фрикционной коллоидной мельницы.
1 - осгювлние с коническим гиодо.и; 2 - отверстие в гнездо; 3 - jtornp;
4- микрометрический спит.
Значительно повышается эффективность диспергирования в РПА с увеличением концентрации суспензии, так как измельчение происходит не только за счет РПА, но и путем интенсивного механического трения частиц дисперсной фазы друг с другом. Полученная концентрированная суспензия смешивается затем с остальной частью дисперсионной среды до получения требуемого готового продукта.

Рис. 20.4. Устройство коллоидной мельницы ударною тши.
1 - nwpnjc; 2 - ДИСК. 3--1 - 1Ы.1ЫШ.
С помощью РПА можно совмещать операции диспергирования порошкообразных веществ и эмульгирования смесей. Таким образом, использование РПА обеспечивает получение многофазных гетерогенных систем - эмульсионно-суспензионных смесей, таких как линимент стрептоцида, синтомицина и т. д.
Применение РПА в химико-фармацевтической промышленности дает возможность получения высококачественной продукции, повышения производительности труда, сокращения непроизводительных расходов и т. д.
Для получения суспензий и эмульсий применяют коллоидные мельницы, работающие по принципу истирания твердых частиц, фрикционные (рис. 20.3), удара (рис. 20.4) или истирания и удара (рис. 20.5), кавитации (рис. 20.6).
Измельчение осуществляется в основном в жидкой среде. Рабочие поверхности мельниц гладкие или рифленые, по форме в виде усеченного конуса - ротора, вращающегося в коническом гнезде - статоре, или в виде плоских дисков, из которых один неподвижен; или оба диска вращаются в разные стороны. На дисках укреплены пальцы или имеются канавки.
При работе фрикционной мельницы ротор вращается со скоростью до 20 000 об/мин, диспергируемая смесь засасывается в щель между ротором и статором, размер которой регулируется микровинтом и составляет 0,025-0,05 мм. Смесь многократно прогоняется через щель до получения суспензии с очень небольшим размером частиц.
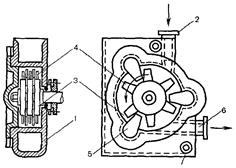
Рис. 20.5. Устройство роторно-бильной коллоидной мельницы.
1 - корпус, 2 - штуцер для ввода суспенани; 3 - ротор; 4 - билльг, 5 - кошрударники;
6 - штуцер для вывода готовой продукции.

Рис. 20.6. Устройство виброкавитационной коллоидной мельницы.
1 - корпус; 2 - статор; 3 - ротор; 4 - канавки ото поверхности ротора и статора; 5 - штуцер для ввода суспензии;
6 - штуцер для вызола готовой продукции.
В коллоидную мельницу, работающую по принципу удара, смесь подается между вращающимся диском и корпусом с насаженными на них пальцами. При вращении диска частицы дисперсной фазы подвергаются мощному гидравлическому воздействию, возникающему в результате бесчисленных ударов пальцев по жидкости, образуя тонкую суспензию или эмульсию.
Весьма эффективными в производстве эмульсий и суспензий являются устройства для ультразвукового диспергирования. При озвучивании гетерогенных жидкостей в зонах сжатия и разрежения возникает давление. Избыточное давление, создаваемое ультразвуковой волной, накладывается на постоянное гидростатическое давление и суммарно может составлять несколько атмосфер. В фазу разрежения во всем объеме жидкости, особенно у границ раздела фаз, в местах, где имеются пузырьки газа и мельчайшие твердые частицы, образуются полости, кавитационные пузырьки. При повторном сжатии кавитационные пузырьки захлопываются, развивая давление до сотен атмосфер. Образуется ударная волна высокой интенсивности, которая приводит к механическому разрушению твердых частиц и вырывает с поверхности раздела фаз небольшие объемы жидкости, распадающиеся на мелкие капельки и снова входящие в нее. В процессе озвучивания системы происходит не только диспергирование частиц, но и коагуляция, если превзойден предел интенсивности ультразвука и вследствие этого нарушена целостность защитных слоев частиц дисперсной фазы. С введением стабилизирующих веществ эффективность эмульгирующего действия ультразвука резко возрастает, повышается и степень дисперсности.
Существует определенная зависимость между интенсивностью ультразвука и типом получаемой эмульсин. При низкой интенсивности ультразвука образуется эмульсия типа масло в воде, с увеличением се - вода в масле.
Для получения ультразвуковых волн используют различные аппараты и установки, генерирующие ультразвуковые колебания. Источниками ультразвука могут быть механические и электромеханические излучатели, последние подразделяют на электродинамические, магнитострикционные и электрострикциониые.
К преобразователям механической энергии в ультразвуковую относится жидкостной свисток.
Принцип его работы заключается в подаче под давлением струи жидкости через сопло на острие закрепленной в двух точках пластинки (рис. 20.7). Под ударом струи жидкости пластинка колеблется и излучает два пучка ультразвука, направленных перпендикулярно к ее поверхности. При получении эмульсин жидкостной свисток помещают в сосуд с дисперсионной средой и через него под давлением в несколько атмосфер подают дисперсную фазу. Частота колебаний, возбуждаемых излучателем, составляет около 30 кГц.
К электродинамическим излучателям относится высокочастотный ротационный аппарат, построенный по типу турбинной мешалки. Возбудимый им ультразвук имеет низкую интенсивность.

Рис. 20.7. Жидкостной свисток (схема).
1 - сопло, 2 - ичб(ыцио1шая пластично; 3 - пучки ультроэауха.
Магнитострикционные излучатели (рис. 20.8) представляют собой вибрационные устройства, состоящие из магиитопровода (металлического стержня) с обмоткой, вмонтированного в сосуд с диспергируемой средой. Магнитопровод изготавливают из ферромагнитных металлов, различных сплавов и других материалов, способных менять линейные размеры при намагничивании. Такими свойствами обладают никель, железо, кобальт, нержавеющая сталь, сплавы в системах железо - никель, железо - кобальт и др. Для уменьшения потерь на вихревые токи магнитопровод изготавливают из тонких изолированных друг от друга пластин толщиной 0,1-0,3 мм, покрытых никелем. Во избежание повышения температуры при работе магнитостриктора внутри металлического стержня оставляют узкий канал, через который для его охлаждения циркулирует холодная вода. При пропускании по обмотке переменного тока соответствующей частоты возникает магнитное поле и происходит деформация магнитопровода по его продольной оси. Образуются ультразвуковые колебания, размах которых увеличивается, когда излучатель работает в условиях резонанса возбуждаемых частот и собственных колебаний стержня.

Рис.20.8. Устройство магннтострнкцнонного излучателя.
1 - сосуд;2 - никелевый стержень; 3 - муфта; 4 - обмотка для пропускания переменного тока.
Электрострикционные (пьезоэлектрические) излучатели представляют собой устройства, действие которых основано на пьезоэлектрическом эффекте, используются при получении ультразвука высокой частоты, от 100 до 500 кГц. Пьезоэлементами служат пластинки, изготовленные из кварца или других кристаллов, колеблющихся по толщине. Эти пластинки имеют прямоугольную форму, размер их не менее 10 X 15 X 1 мм3. Одна из граней пластинки должна быть параллельна оптической оси кристалла, другая - одной из его электрических осей. Для создания резонанса частот пластинка с обеих сторон снабжается металлическими обкладками. При сжатии или растяжении таких пластинок вдоль электрической оси, на их поверхности возникают противоположные электрические заряды. Это явление называется пьезоэффек-том. При наложении электрического поля пластинка испытывает деформацию растяжения (при отрицательном заряде) или сжатия (при положительном заряде), т. е. в переменном электрическом поле прьезоквар-цевая пластинка совершает резонансные колебания (обратный пьезоэлектрический эффект). Для повышения интенсивности излучателя изменяют форму пластинки и применяют вогнутые, сферические и цилиндрические излучатели.
Схема диспергирования с помощью электрострик-ционного излучателя представлена на рис. 20.9. Пьезоэлектрический элемент (1) устанавливается в масляной бане на специальном механизме (2) (масло играет роль изолирующего агента и является хорошим проводником акустической энергии). Над ним на расстоянии около 5 мм закрепляется колба с диспергируемыми веществами. К пьезоэлементу (металлическим обкладкам пластинки) подводится источник переменного тока высокой частоты через газотронный выпрямитель н генератор, чтобы направление тока совпало с электрической осью элемента. Чередующиеся сжатия и разрежения в масле от пьезоэлемента передаются через стекло колбы в диспергируемую систему. Для предохранения от перегрева содержимого колбы вокруг нее размещают змеевик для пропускания холодной воды.

Рис. 20.9. Устройство электрострикционного излучателя.
Объяснение в тексте.
Применение ультразвука дает возможность получить монодисперсные системы с размером частиц дисперсной фазы в интервале 0,1-1,0 мкм и менее 0,1 мкм. Однородность и высокая степень дисперсности обеспечивает их более высокую биологическую доступность. Суспензии и эмульсии, полученные с помощью ультразвука, отличаются большей устойчивостью при хранении, чем полученные путем механического диспергирования. Озвученные эмульсии называются реверзибильными - возвращенными. В случае расслаивания они легко ресуспендируются при встряхивании.
Благодаря бактерицидному действию усльтразвука, полученные эмульсии и суспензии стерильны.
Стандартизация. Оценка качества готовой продукции проводится по содержанию действующих веществ. Регламентируется показатель значения рН среды, степень дисперсности частиц твердой фазы суспензий и капель эмульсий, скорость оседания частиц дисперсной фазы суспензий. Контролируется термостабильность и морозостойкость эмульсий: при выдерживании пробы эмульсии (30,0 г) в термостате при 45°С в течение 8 ч отделяющийся масляный слой не должен превышать 25% общей высоты эмульсии. При охлажденпи до - 20°С в течение 10 ч после оттаивания при комнатной температуре не должно быть расслаивания.
Хранение. Суспензии и эмульсии хранят в стеклянных флаконах или банках темного стекла, плотно закрытых винтовой крышкой, в прохладном, защищенном от света месте, с указанием на этикетке срока годности препарата.
Номенклатура суспензий и эмульсий многочисленна и разнообразна. Для примера представлены некоторые прописи суспензий, линиментов-эмульсий и линиментов-суспензий промышленного производства.
Линимент нафталанской нефти 10% (Linimentum Naphthalan! liquidi 10%). Состав: нефти нафталанской 10,0 г, эмульгатора № 1 6,0 г, воды дистиллированной до 100,0 г.
Линимент стрептоцида 5% (Linimentum Streptocidi albi 5%). Состав: стрептоцида белого 5,0 г, рыбьего жира трескового или жира других рыб и морских млекопитающих 34,0 г, бутилоксианизола 0,02 г, эмульгатора № 1 5,0-6,0 г, натрия карбокси-метилцеллюлозы 1,68 г, воды дистиллированной до 100,0 г.
Линимент синтомицина 1% с новокаином 0,5% (Linimentum Synthomycini 1% cum Novocaino 0,5%). Состав: синтомицина 1,0 г, новокаина 0,5 г, масла касторового 20,0 г, эмульгатора Лг? 1 4,0-6,0 г, эмульгатора Т-2 4,0 г, кислоты сор-биновой 0,2 г, этанола 95% 1,4 г, воды дистиллированной до 100,0 г.
Линимент алоэ (Linimentum Aloes). Состав: сока алоэ древовидного (консервированного) из био-стимулированных листьев 78,0 г, масла касторового 10,0 г, эмульгатора № 1 10,0 г, масла эвкалипта 0,1 г, кислоты сорбиновой 0,2 г, натрия карбоксиметилцсл-люлозы 1,5 г.
Суспензия гризеофульвина (Suspensio Griseoiulvini). Состав: гризеофульвина 1,0 г, сахара 50,0 г, натрия бензоата 0,5 г, спирта поливинилового 1,2 г, натрия хлорида 0,4 г, раствора сахарина 0,4 мл, масла мяты перечной 0,015 г, воды дистиллированной до 100,0 г.
Вий охи нол (Biiochinolum). Состав: 8% взвесь хинина йодовисмутата в нейтрализованном масле персиковом.
Суспензии инсулина см. главу 18.
Контрольные вопросы
1. Какими методами получают суспензии и эмульсин на фармацевтических производствах?
2. Какие факторы обусловливают устойчивость суспензий н эмульсий?
3. Какую роль играют вспомогательные вещества в производстве суспензий и эмульсий?
4. Из каких стадий складывается процесс получения дисперсионных препаратов?
5. Какие препараты используются в производстве суспензий и эмульсии?
6. Каков принцип работы турбинных мешалок и РПА?
Глава 21
МАЗИ (UNGUENTA)
Определение мазей как лекарственной формы, требования, предъявляемые к ним, классификацию и характеристику мазевых основ см. том 1.
Дата добавления: 2015-10-28; просмотров: 579 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ФЕРМЕНТЫ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА (ФЕРМЕНТЫ, СИНТЕЗИРУЕМЫЕ МИКРООРГАНИЗМАМИ) | | | ТЕХНОЛОГИЯ МАЗЕЙ |