
Читайте также:
|
ТИТРИМЕТРИЯ НА ОСНОВЕ РЕАКЦИЙ НЕЙТРАЛИЗАЦИИ
ТИТРОВАНИЕ СИЛЬНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ
Обозначения и определение:
V o начальный объем кислоты
V объем добавленного титранта
CHAV o начальное число молей (миллимолей) кислоты
CBV убыль содержания кислоты в ходе титрования сильным основанием ВОН.
f Степень оттитрованности - отношение числа молей (миллимолей) основания-титранта к числу молей (миллимолей) титруемой кислоты:

HCl + NaOH = NaCl + H2O
H+ + OH- = H2O
 V(NaOH)
V(NaOH)
Кривая титрования 50 мл 0.1М раствора HCl 0.1М раствором NaOH
1) [H+] до начала титрования, f = 0

2) [H+] до точки эквивалентности, f от 0 до 1

пример:

3) [H+] в точке эквивалентности, f = 1
[H+] = [OH–] = 10–7 M (при 25 °С)

4) [H+] после точки эквивалентности, f >1



пример:

L_M_N_OGP3QSRJT.P UWV XZY3['Y3[_U_\ ]_^G''a_b3'_c_d_e_aWf_f g3h%i jSk_j_l_m_n_oGp_k_k q_r s7t
Расчетные изменения концентрации при тировании 50 мл 0.1М раствора HCl 0.1М раствором NaOH
| V, мл 0.1 M NaOH | ΔV, мл | рН |
| 0.0 | – | |
| 40.9 | 40.9 | |
| 49.01 | 8.11 | |
| 49.90 | 0.89 | |
| 49.990 | 0.09 | |
| 49.9990 | 0.009 | |
| 50.0000 | 0.001 | |
| 50.0010 | 0.001 | |
| 50.010 | 0.009 | |
| 50.10 | 0.09 | |
| 51.01 | 0.91 | |
| 61.1 | 10.09 |

Кривые титрования сильной кислоты (HCl) сильным основанием (NaOH) с концентрацией 1, 0.1 и 0.01 М
ТИТРОВАНИЕ СИЛЬНОГО ОСНОВАНИЯ СИЛЬНОЙ КИСЛОТОЙ
Обозначения:
V o начальный объем основания
V объем добавленного титранта
CBV o начальное число молей (миллимолей) основания
CHAV убыль содержания основания в ходе титрования.

1) [H+] до начала титрования, f = 0
 |  | ||
2) [H+] до точки эквивалентности, f от 0 до 1

или

3) [H+] в точке эквивалентности, f = 1
[H+] = [OH–] = 10–7 M (при 25 °С)
4) [H+] после точки эквивалентности, f >1

КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ
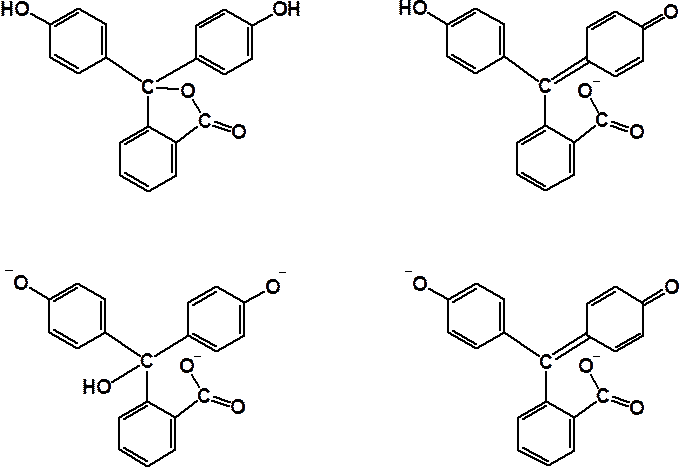
ФЕНОЛФТАЛЕИН

МЕТИЛОВЫЙ ОРАНЖЕВЫЙ
СВОЙСТВА НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ ИНДИКАТОРОВ
| Индикатор | Интервал перехода | Цвет | |
| кисл. форма | осн. форма | ||
| Тимоловый синий | 1.2–2.8 | Красный | Желтый |
| Метиловый оранжевый | 3.2–4.4 | Красный | Желтый |
| Бромкрезоловый зеленый | 3.9–5.4 | Желтый | Синий |
| Метиловый красный | 4.2–6.2 | Красный | Желтый |
| Бромтимоловый синий | 6.0–7.6 | Желтый | Синий |
| Тимоловый синий | 8.0–9.2 | Желтый | Синий |
| Фенолфталеин | 8.0–9.8 | Б/ц | Малинов. |
| Ализариновый желтый | 10.1–12.0 | Желтый | Фиолет. |
ПОДОБРАТЬ ИНДИКАТОР

Кривые титрования 1, 0.1 и 0.01 М соляной кислоты раствором NaOH
ТИТРОВАНИЕ СЛАБОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ
кривая титрования 50 мл 0.1М уксусной кислоты 0.1М раствором NaOH
1) Начальная точка кривой титрования, f = 0
 |
Дата добавления: 2015-10-26; просмотров: 261 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Накафит(англ. NACAPHITE) - Na2Ca(PO4)F | | | После начала титрования, f от 0 до 1 |