
Читайте также:
|
1.Теорія і рівняння адсорбції Ленгмюра.
(Варіанти: рівняння Фрейндліха, рівняння Гіббса, теорія БЕТ).
2. За рівнянням Фрейндліха обчислити рівноважну концентрацію етанової кислоти, якщо 1г вугілля адсорбує 3,76ммоль СН3СООН. Константи: К=2,82; n=2,44.
3. Активна площа поверхні 1г силікагелю складає
465 м2. Скільки молекул брому поглинається 1 см2 поверхні адсорбенту при адсорбції 5 мг брому на 10 г силікагелю.
4. Обчислити величину адсорбції Гіббса розчину етанової кислоти при 15 ºС концентрацією 0,12 моль/л, якщо його поверхневий натяг 70,9 мДж/м2, а поверхневий натяг води – 73,6 мДж/м2.
ХІД РОБОТИ
Із вихідного розчину етанової кислоти концентрацією 0,4 моль/л методом розбавлення водою приготуйте такі розчини у колбах ємністю 100 мл.
Досліджувані розчини
| Компоненти | Розчин №1 | Розчин №2 | Розчин №3 | Розчин №4 | Розчин №5 |
| CH3COOH,мл Н2О, мл | 5,0 | 12,5 17,5 | 1,0 19,0 |
Із кожної колби відберіть піпеткою по 5 мл відповідного розчину і відтитруйте їх розчином лугу в присутності фенолфталеїну, визначаючи концентрацію вихідних розчинів. Розчини перших трьох колб титрують 0,2 н розчином NaOH, а 4 і 5 колбу – 0,02 н NaOH.
У кожну з колб, в яких міститься по 15 мл розчину, внесіть по 0,5 г активованого вугілля і витримайте їх протягом 15-20 хв., періодично перемішуючи. Після цього вміст всіх колбочок профільтруйте у 5 сухих колб. Із кожного фільтрату відберіть піпеткою по 5 мл розчину і відтитруйте їх, як і в випадку вихідних розчинів, розчини № 1, 2 і 3 – 0,2н NaOH, а № 4 і 5 – 0,02н NaOH до одержання слаборожевого забарвлення фільтрату, яке не зникає.
За даними титрування визначіть концентрації кислоти у кожній колбочці до адсорбції (Сок) і після адсорбції (С´к) за формулою:
Ск·Vк = Сл·Vл
де Ск, Сл – відповідно концентрації лугу і кислоти, моль/л.
Vк – об’єм кислоти, взятої на титрування, мл
Vл – об’єм лугу, затраченого на титрування, мл
Так як об’єм розчину, з якого проводилась адсорбція
15 мл, то кількість адсорбованої кислоти на одиницю маси адсорбента в ммоль/г обчисліть за формулою:
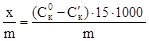
- де х - кількість адсорбованої кислоти.
- 1000 – коефіцієнт переводу моль в ммоль
- m – маса адсорбента.
Результати занесіть у таблицю.
Результати досліджень
| № дос. | До адсорбції | Після адсорбції | 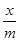
| 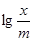
| lg(C′к· ·1000) | ||||||
| Сол | Vол | Cок | Vок | С′л | V′л | C′к | V′к | ||||
| 0,2 0,2 0,2 0,02 0,02 |
Так як 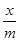 виражається в ммоль/г, то і C′к необхідно виражати
виражається в ммоль/г, то і C′к необхідно виражати
в ммоль/л (C′к·1000).
ЗВІТ ПРО РОБОТУ.
1. Використовуючи одержані дані, побудуйте графік в координатах 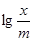 - lg(C′к·1000); та графічно визначіть величини lg K i n.
- lg(C′к·1000); та графічно визначіть величини lg K i n.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
Завдання І
За рівнянням Фрейндліха обчисліть рівноважну концентрацію етанової кислоти, якщо активоване вугілля масою m (г) адсорбує х (ммоль) СНзСООН.
| № | m | х | Константи рівняння Фрейндліха | № | m | х | Константи рівняння Фрейндліха | ||
| К | n | К | n | ||||||
| 2,82 | 2,44 | 1,8 | 2,76 | 2,39 | |||||
| 2,5 | 2,63 | 2,35 | 2,6 | 2,58 | 2,14 | ||||
| 2,6 | 2,87 | 2,49 | 2,5 | 2,64 | 2,23 | ||||
| 2,4 | 2,95 | 2,59 | 2,9 | 2,88 | 2,46 | ||||
| 2,1 | 2,45 | 2,06 | 2,5 | 3,00 | 2,50 | ||||
| 2,6 | 2,56 | 2,26 | 2,1 | 2,93 | 2,49 | ||||
| 2,9 | 2,67 | 2,40 | 1,5 | 2,57 | 2,09 | ||||
| 1,6 | 2,85 | 2,45 | 2,54 | 2,10 |
Дата добавления: 2015-09-01; просмотров: 55 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Зразок картки контролю знань | | | Завдання II |