
|
Читайте также: |
1. Закон Бойля-Маріотта (ізотермічний процес):
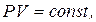 при Т= const, m=const.
при Т= const, m=const.
2. Закон Гей-Люссака (ізобарний процес):
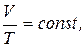 при P = const, m = const.
при P = const, m = const.
3. Закон Шарля (ізохорний процес):
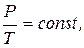 при V = const, m = const.
при V = const, m = const.
4. Рівняння Менделєєва:-Клапейрона: 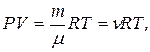
де P – тиск газу; V – його об’єм, Т – абсолютна температура, m – маса газу, μ - молярна маса газу, ν – кількість речовини, 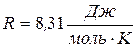 - універсальна газова стала.
- універсальна газова стала.
5. Основне рівняння молекулярно-кінетичної теорії газів:
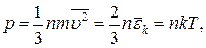
де n – концентрація молекул, m – маса однієї молекули, 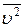 - середня квадратична швидкість теплового руху молекул, k – стала Больцмана,
- середня квадратична швидкість теплового руху молекул, k – стала Больцмана, 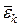 - середня кінетична енергія поступального руху однієї молекули.
- середня кінетична енергія поступального руху однієї молекули.
6. Кількість теплоти при зміні температури на ΔТ речовини масою 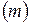 :
: 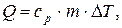 де ср – питома теплоємність речовини за сталого тиску.
де ср – питома теплоємність речовини за сталого тиску.
7. Питома теплоємність газу за сталого об’єму і сталого тиску відповідно дорівнюють: 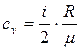 ;
; 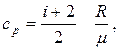
де і – число степенів вільності. Для одноатомних молекул і = 3, двохатомних і = 5, для три- і більше атомних молекул і = 6.
8. Молярна теплоємність газу при сталому об’ємі і тиску відповідно дорівнюють: 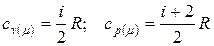 .
.
9. Зміна внутрішньої енергії газу при сталому об’ємі: 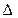 U =cv ∙ m ∙ ∆T, або в диференціальній формі:
U =cv ∙ m ∙ ∆T, або в диференціальній формі:
dU = cv ∙ m ∙ dT.
10. Перший закон термодинаміки для замкнутих систем:
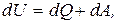
де dU – зміна внутрішньої енергії системи;
dQ – кількість теплоти одержаної або відданої системою в процесі теплопередачі;
dA – робота виконана системою або над системою.
Елементарна робота газу при сталому тиску: 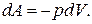
11. Робота при ізобарному процесі:
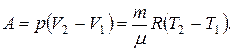
12. Робота при ізотермічному процесі:
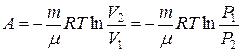 .
.
13. Зміна ентропії:
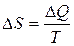 - при сталій температурі,
- при сталій температурі,
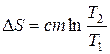 - при зміні температури тіла від Т 1 до Т 2,
- при зміні температури тіла від Т 1 до Т 2,
де m – маса тіла;
с – питома теплоємність речовини,
Т – абсолютна температура термодинамічної системи.
14. Дихальний коефіцієнт (ДК):
ДК = Vco2 /Vo2,
де Vco2 - об’єм виділеного з організму в процесі дихання со2;
Vo2 - об’єм спожитого за той же час кисню.
15. Коефіцієнт поверхневого натягу:
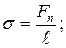
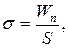
де 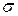 – коефіцієнт поверхневого натягу, Fn – сила поверхневого натягу, що діє на контур довжиною l, Wn – поверхнева енергія рідини з вільною поверхнею площею S.
– коефіцієнт поверхневого натягу, Fn – сила поверхневого натягу, що діє на контур довжиною l, Wn – поверхнева енергія рідини з вільною поверхнею площею S.
16. Визначення коефіцієнта поверхневого натягу:
а) методом підняття рідини в капілярі: 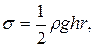
де 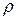 – густина рідини, h – висота її підняття, r – радіус капіляра g – прискорення вільного падіння;
– густина рідини, h – висота її підняття, r – радіус капіляра g – прискорення вільного падіння;
б) методом відриву кільця: 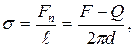
де F – сила, що діє на кільце в момент його відриву, Q – сила тяжіння, d – усереднений діаметр кільця.
17. Додатковий тиск Лапласа:
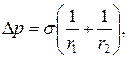
де r1 i r2 – радіуси кривизни поверхонь бульбашки, яка переміщується з рідиною по циліндричній трубці.
Для випадку r1 = r2 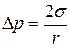 .
.
18. Закон Ньютона для в’язкості:
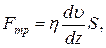
де Fтр –сила внутрішнього тертя між шарами рідини; S – площа дотику шарів рідини, 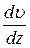 = grad
= grad 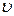 – градієнт швидкості шарів рідини, η – коефіцієнт внутрішнього тертя (в’язкості).
– градієнт швидкості шарів рідини, η – коефіцієнт внутрішнього тертя (в’язкості).
19. Сила внутрішнього тертя, що діє з боку рідини на рухому кульку радіусом r (сила Стокса):
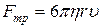 .
.
20. Визначення коефіцієнта в’язкості рідини методом Стокса:
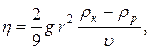
де r – радіус кульки, ρк – її густина, ρр – густина рідини, 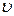 – швидкість руху кульки в рідині, g - прискорення вільного падіння.
– швидкість руху кульки в рідині, g - прискорення вільного падіння.
Дата добавления: 2015-09-01; просмотров: 66 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Фізичні основи механіки | | | Електростатика |