
Читайте также:
|
У IV групі знаходяться катіони Cr3+, Al3+, Zn3+, As3+, As5+, Sn2+, Sn4+. Катіони IV групи осідають із розчинів гідроксидом натрію, опади розчиняються в надлишку реактиву. NaOH є груповим реагентом на катіони IV групи. При дії NaOH утворюються осади гідроксидів катіонів IV групи (крім миш'яку): зелений Cr(OH)3, білі Al(OH)3, Zn(OH)2, Sn(OH)2, H2 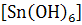 . Осади гідроксидів виявляють амфотерні властивості і розчиняються в надлишку NaOH, утворюючи солі відповідних кислот: NaAlO2, NaCrO2, Na2ZnO2, Na2SnO2, Na2
. Осади гідроксидів виявляють амфотерні властивості і розчиняються в надлишку NaOH, утворюючи солі відповідних кислот: NaAlO2, NaCrO2, Na2ZnO2, Na2SnO2, Na2  , з кислотами вони утворюють солі катіонів. Систематичний аналіз катіонів IV групи проводять наступним чином. У розчині дробовими реакціями виявляють миш'як, хром і олово, потім пероксидом водню в лужному середовищі переводять усі катіои у вищий ступінь окислення (As3+
, з кислотами вони утворюють солі катіонів. Систематичний аналіз катіонів IV групи проводять наступним чином. У розчині дробовими реакціями виявляють миш'як, хром і олово, потім пероксидом водню в лужному середовищі переводять усі катіои у вищий ступінь окислення (As3+ 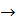 As5+, Cr3+
As5+, Cr3+ 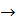 Cr6+; Sn2+
Cr6+; Sn2+ 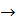 Sn4+). Додаванням NH4Cl до слаболужного середовища осаджують Al(OH)3 і, Sn(OH)4, осад розчиняють в HCl і аналізують. Фільтрат після відділення Al3+ і Sn4+ аналізують на присутність миш'яку, хрому, цинку.
Sn4+). Додаванням NH4Cl до слаболужного середовища осаджують Al(OH)3 і, Sn(OH)4, осад розчиняють в HCl і аналізують. Фільтрат після відділення Al3+ і Sn4+ аналізують на присутність миш'яку, хрому, цинку.
Дослід 2 Характерна реакція катіонів Сr3+
Характерною реакцією на катіон Сг3+ є окислення його до CrO42-, який має специфічний жовтий колір.
До 3-5 крапель розчину солі хрому (ІП) долийте надлишок лугу до розчинення осаду, що спочатку утворився. Потім додайте 6-8 крапель 6%-ного розчину пероксиду водню і суміш нагрівайте до зміни її забарвлення. Складіть рівняння реакції.
Дослід 7 Характерні реакції на Al3+
1. Луги (NaOH або KOH). У надлишку лугів Al(OH)3 розчиняється з утворенням алюмінатів. Алюмінати, як солі слабких кислот, підлягають гідролізу у водних розчинах. Рівновага зміщується вправо або вліво залежно від концентрації іонів Н+ і ОН- у розчині, тобто від рН розчину. Якщо до алюмінату додати сухий NH4Cl або його насичений розчин, то останній реагує з їдким натром: NH4Cl+NaOH=NaCl+NH4OH.
При утворенні NH4OH замість NaOH рН розчину зменшується до 7-8, коли Al(OH)3 робиться стійким, тобто рівновага зміщується вправо і знову випадає осад Al(OH)3.Цьому сприяє підігрівання розчину.
Хід виконання реакції. До 3-4 крапель розчину солі Al3+ додати 1-2 краплі 2н. розчину NaOH до утворення осаду Al(ОН)3, а далі додати надлишок цього ж лугу до розчинення осаду. До одержаного алюмінату додати 2-3 мл дистильованої води і NH4Cl (кристали) до утворення насиченого розчину. Суміш підігріти на водяній бані. Утворюється пластівчастий аморфний осад Al(ОН)3.
Заважає проходженню реакції наявність Mn2+, Fe2+, Fe3+, які з NH4OH утворюють осади. Повинні бути відсутні винна, лимона, щавлева кислота, гліцерин, які утворюють стійкі комплексні сполуки з Al3+, типу H3[Al(C4H4O6)3], H3[Al(C2O4)3] та інші.
2. Реактивом на А13+ є алізарин (1,2-діоксоатрахінон).
До розчину солі алюмінію додайте декілька крапель розчину аміаку до отримання лужної реакції за індикаторним папірцем. До одержаного розчину долийте декілька крапель розчину алізарину. Зафіксуйте колір алізарин-алюмінієвого лаку, що утворився.
Дослід 2 Характерні реакції на Zn2+
1. NH4OH.
Хід виконання реакції. До 3-4 крапель розчину солі цинку додати 2-3 краплі розчину NН4ОН до утворення білого осаду Zn(OН)2. Перевірити розчинність осаду в надлишку розчину NН4ОН.
2. Луги (NaОН або КОН).
Хід виконання реакції. До 10-12 крапель розчину солі цинку додати повільно 2-3 краплі розчину NaОH або КОН до утворення білого осаду Zn(ОH)2.
Перевірити розчинність одержаного осаду в мінеральних кислотах, оцтовій кислоті та у надлишку лугів (NaОН або КОН). Для цього одержаний осад розділити на 4 пробірки, і в кожну з трьох пробірок додати відповідний розчинник.
3. Розчин гексаціаноферату (II) калію K4[Fe(CN)6].
Хід виконання реакції. До 2-3 крапель розчину солі цинку додати 1 краплю НС1 та 2-3 краплі K4[Fe(CN)6]. Суміш підігріти. Перевірити розчинність осаду в лугах і в надлишку розчину K4[Fe(CN)6].
4. Розчин гексаціаноферату (ІІІ) калію К3[Fe(CN)6].
Хід виконання реакції. До 2-3 крапель розчину солі цинку додати 1 краплю НС1 та 1-2 краплі К3[Fe(CN)6].
Перевірити розчинність утвореного осаду в лугах і у мінеральних кислотах.
Дослід 5 Характерна реакція катіонів Sn2+
Характерною реакцією на Sn2+ є їх взаємодія з розчином солі
вісмуту (ПІ). За необхідності відкриття іонів Ві3+ використовується ця сама реакція, тільки у ролі реактиву виступає сіль олова (П).
До 0,5-1 мл солі олова (II) додайте подвійний об'єм 2н розчину гідроксиду натрію і перемішайте. Потім по стінці пробірки пустіть 2-3 краплини розчину солі вісмуту (III). У місці контакту розчинів утворюється вінчик металевого вісмуту. Завершіть рівняння реакції:
Na2[Sn(OH)4] + ВіСІ3 + NaOH →...
4. Схема аналізу катіонів ІV групи (кислотно-основна класифікація)

Дата добавления: 2015-09-05; просмотров: 86 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Систематичний аналіз катіонів I-III груп | | | Аналіз катіонів V аналітичної групи |