
Читайте также:
|
Молекула воды имеет угловое строение: входящие в её состав ядра образуют равнобедренный треугольник, в основании которого находятся два водорода, а в вершине – атом кислорода. Межъядерные расстояния О – Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм. Из шести электронов, составляющих внешний электронный слой атома кислорода в молекуле воды, две электронные пары образуют ковалентные связи О-Н, а остальные четыре электрона представляют собой две неподелённые электронные пары (рисунок 1).



Рисунок 1 – Модели строения молекулы воды [3]
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов, получится объемная геометрическая фигура – правильный тетраэдр (рисунок 1) [19,20].
С позиций метода валентных связей образование химических связей в молекуле воды можно объяснить за счёт перекрывания двух одноэлектронных p-облаков атома кислорода и одноэлектронных s-облаков двух атомов водорода. Ввиду того что участвующие в образовании химических связей p-облака кислорода расположены относительно друг друга под углом в 90 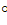 , валентный угол НОН должен был также соответствовать этому значению. Однако в действительности он состовляет 104,5
, валентный угол НОН должен был также соответствовать этому значению. Однако в действительности он состовляет 104,5 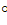 . Отклонение валентного угла от ожидаемого можно объяснить с двух позиций.
. Отклонение валентного угла от ожидаемого можно объяснить с двух позиций.
Согласно одной из них увеличение валентного угла с 90 до 104,5 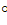 можно объяснить отталкиванием атомов водорода, который вследствие большой разности в электроотрицательности с кислородом (разность составляет 1,4 по шкале Полинга) приобретают в молекуле воды частичный положительный заряд (плюс 0,33 на каждом атоме). Эффективный заряд атома кислорода составляет минус 0,66.
можно объяснить отталкиванием атомов водорода, который вследствие большой разности в электроотрицательности с кислородом (разность составляет 1,4 по шкале Полинга) приобретают в молекуле воды частичный положительный заряд (плюс 0,33 на каждом атоме). Эффективный заряд атома кислорода составляет минус 0,66.
С точки зрения концепции гибридизации атом кислорода должен находится в состоянии sp3-гибридизации, в которой принимают участие две орбитали с неподелёнными электронными парами и две орбитали, осуществляющие связи с водородом. В соответствии с этим валентный угол между тетраэдрически расположенными в пространстве орбиталями кислорода должен составить порядка 109,5 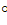 . Отклонение валентного угла НОН от тетраэдрического можно объяснить тем, что электронные пары связи О – Н занимают в пространстве меньший объём, чем неподелённые пары кислорода [3].
. Отклонение валентного угла НОН от тетраэдрического можно объяснить тем, что электронные пары связи О – Н занимают в пространстве меньший объём, чем неподелённые пары кислорода [3].
Особенности строения молекулы воды имеют важные следствия.
Во-первых, из-за неравномерности распределения электронной плотности валентных электронов молекула Н2О представляет собой диполь с отрицательным полюсом на кислороде и положительным со стороны атома водорода. Дипольный момент воды составляет 6,17  10-30 Кл
10-30 Кл  м. Это достаточно большая величина. Для сравнения, дипольный момент метана равен 0, аммиака – 4,44
м. Это достаточно большая величина. Для сравнения, дипольный момент метана равен 0, аммиака – 4,44  10-30 Кл
10-30 Кл  м.
м.
Во-вторых, большой дипольный момент воды является причиной возникновения диполь-дипольных и ион-дипольных взаимодействий в водных растворах.
В-третьих, молекула воды образует водородные связи.
В-четвёртых, неподелённые электронные пары кислорода позволяют Н2О выступать в качестве лиганда с образованием комплексных соединений [3].
Вода имеет очень высокие температуры замерзания (0  ) и кипения (100
) и кипения (100  ) (рисунок 2). Это позволяет ей существовать во всех агрегатных состояниях: твердом (лед), жидком (вода) и газообразном (пар) (рисунок 3).
) (рисунок 2). Это позволяет ей существовать во всех агрегатных состояниях: твердом (лед), жидком (вода) и газообразном (пар) (рисунок 3).

Рисунок 2 – Аномалии точек кипения и замерзания воды
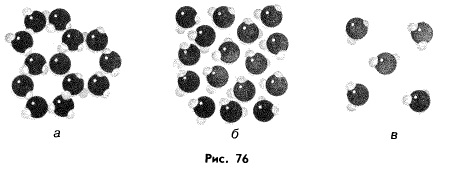
Рисунок 3 – Агрегаты состояния воды: а – лед, б – вода, в – пар [2]
Из одиночных молекул вода состоит в парообразном состоянии. При температуре ниже температуры кипения, когда кинетическая энергия молекул становится ниже их потенциальной энергии взаимодействия, вода, как и любое вещество в этом случае, переходит в жидкое состояние. Но температура этого фазового перехода для воды почти на 200  выше, чем это следовало бы ожидать из характера того межмолекулярного взаимодействия, которое должно осуществлять между подобными ей по составу молекулами, например сероводорода.
выше, чем это следовало бы ожидать из характера того межмолекулярного взаимодействия, которое должно осуществлять между подобными ей по составу молекулами, например сероводорода.
Высокая полярность воды является лишь одной из причин ассоциации молекул воды, которые могут комбинироваться по две, три и более вследствие взаимного притяжения противоположно заряженных концов диполя [3].
Главной причиной образования ассоциатов (Н2О)х являются водородные связи [3]. В твердом состоянии атом кислорода каждой молекулы воды образует две водородные связи (показаны пунктиром) с соседними молекулами по схеме (рисунок 4) [4]. Благодаря им жидкая вода – это не разупорядоченное движение молекул, а состояние, близкое к аморфному. В нём молекулы воды ассоциированы в агрегаты (Н2О)х – кластеры со степенью ассоциации (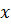 ) до 130 молекул воды при 0
) до 130 молекул воды при 0 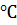 , до 90 – при 20
, до 90 – при 20 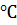 , до 60 – при 72
, до 60 – при 72 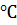 (рисунок 5) [3].
(рисунок 5) [3].
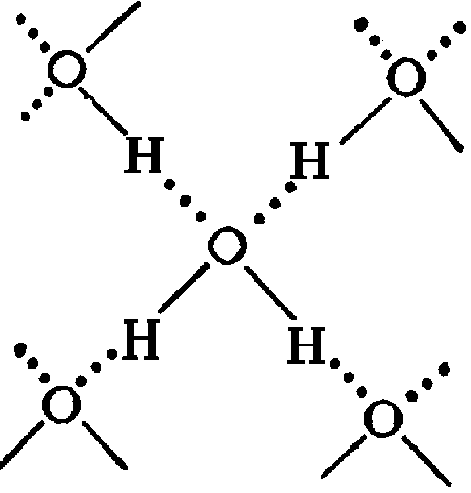
Рисунок 4 – Схема образования водородных связей [4]
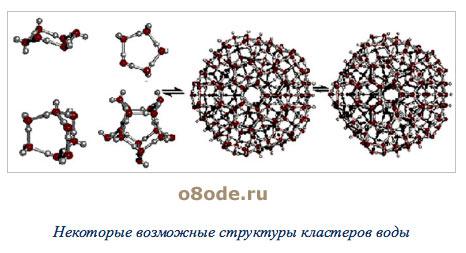
Рисунок 5 – Некоторые возможные структуры кластеров воды
Время жизни таких кластеров небольшое (10-11 – 10-10 с). В их образовании участвуют не все молекулы, иначе бы их плотность в жидком состоянии должна была бы составить не  1 г/см3, а 1,84 г/см3. Последняя величина рассчитана из предположения плотной упаковки молекул Н2О с радиусом, равным 1,38
1 г/см3, а 1,84 г/см3. Последняя величина рассчитана из предположения плотной упаковки молекул Н2О с радиусом, равным 1,38  , который определен из размеров кристаллической решетки льда [3].
, который определен из размеров кристаллической решетки льда [3].
Схема кристаллической решетки льда представлена на рисунке 6. Каждая молекула Н2О (черные шарики) окружена тетраэдрически четырьмя другими молекулами – тремя из того же слоя и одной из соседнего слоя молекул. Структура льда является наименее плотной структурой. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул Н2О. При плавлении льда часть водородных связей разрушается, и в пустотах оставшихся агрегатов могут разместиться отдельные молекулы воды, вследствие чего достигается более плотная упаковка молекул. Поэтому при плавлении льда объем воды уменьшается, а плотность возрастает.
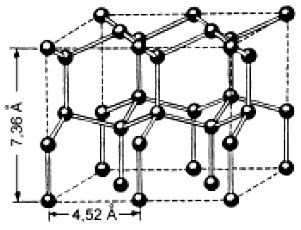
Рисунок 6 – Кристаллическая решетка льда [4]
Дата добавления: 2015-08-20; просмотров: 256 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Молекула воды | | | Физические свойства воды |