
Читайте также:
|
Как было показано выше многие кислые соли термически нестабильны, и разлагаются при нагревании. Здесь приведём ещё две реакции; первая служит для устранения временной жёсткости воды, а вторая при выпечке изделий из теста:
Ca(HCO3)2 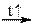 CaCO3 + H2O↑ + CO2↑ NH4HCO3
CaCO3 + H2O↑ + CO2↑ NH4HCO3 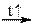 NH3↑ + CO2↑ + H2O
NH3↑ + CO2↑ + H2O
Кислые соли могут взаимодействовать с металлами, стоящими в ряду напряжений до водорода, например;
2 KHSO4 + Zn → ZnSO4 + K2SO4 + H2↑
Кислые соли реагируют с основными оксидами:
NaH2PO4 + Na2O → Na3PO4 + H2O
С амфотерными оксидами:
6 Na2HPO4 + Al2O3 → 2 AlPO4↓ + 4 Na3PO4 + H2O
Кислые соли реагируют со щелочами, давая либо другие кислые соли, либо средние соли:
KH2PO4 + KOH → K2HPO4 + H2O K2PO4 + 2 KOH → K3PO4 + 2 H2O
Кислые соли могут реагировать с нерастворимыми в воде основаниями:
2 La(OH)3 + 6 KHSO4 → La2(SO4)3 + 6 H2O + 3 K2SO4
А также с нерастворимыми в воде амфотерными гидроксидами:
Cu(OH)3 + 2 NaHSO4 → CuSO4 + Na2SO4 + 2 H2O
Кислые соли могут реагировать с кислотами, давая другие кислые соли:
Li2HPO4 + H3PO4 → 2 LiH2PO4
Они могут реагировать с аммиаком или гидратом аммиака:
NH4H2PO4 + NH3 → (NH4)2HPO4 + H2O
NH4H2PO4 + 2 (NH3 • H2O) → (NH4)3PO4 + 2H2O
Кислые соли как электролиты могут участвовать в процессе электролиза:
KH2PO4  K+ + H2PO4− H2O
K+ + H2PO4− H2O  OH−
OH−

4 OH− + 4 Н+  2H2↑ + 2 H2O + О2↑
2H2↑ + 2 H2O + О2↑
2 H2O  2 H2↑ + О2↑
2 H2↑ + О2↑
Дата добавления: 2015-08-17; просмотров: 93 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Физические свойства кислых солей | | | Способы получения основных солей. |