
Читайте также:
|
Мельчайшие частицы незначительной массы испытывают неодинаковые удары со стороны молекул дисперсионной среды, на рисунке показана результирующая сила F, которая заставляет частицы двигаться.
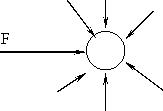
Рис.7.3.Воздействие молекул дисперсионной среды на частицу дисперсной фазы.
Направление и импульс этой силы непрерывно меняются, поэтому частицы совершают хаотичное движение
Определить направление результирующей силы и связать его с молекулярно-кинетическими свойствами среды удалось в 1907 году независимо друг от друга Эйнштейну и Смолуховскому.
В основу их расчетов был взят не истинный путь частиц, а сдвиг частиц (рис.7.4). 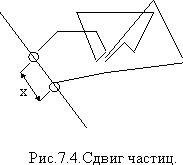
Путь частицы определяется ломаной линией, а сдвиг х характеризует изменение координаты частицы за определенный промежуток времени. Средний сдвиг будет определять среднеквадратичное смещение частицы:

х1, х2,хi - сдвиги частицы за определенное время
Теория броуновского движения исходит из представления о взаимодействии случайной силы f(t), которая характеризует удары молекул и, и силы Ft, зависящей от времени и силы трения при движении частиц дисперсной фазы в дисперсионной среде со скоростью v. Уравнение броуновского движения (уравнение Ланжевена) имеет вид:
m(dv/dt) + hv = Ft + f(t) (7.7)
где m - масса частицы, h - коэффициент трения при движении частиц.
Для больших промежутков времени инерцией частиц, то есть членом m(dv/dt) можно пренебречь. После интегрирования 7.7. при условии, что среднее произведение импульсов случайной силы равно нулю находят средний сдвиг:
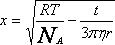
где t - время, h - вязкость дисперсионной среды, r -радиус частиц дисперсной фазы.
Броуновское движение наиболее ярко выражено у высокодисперсных систем. Уяснение причин и разработка теории броуновского движения - блестящее доказательство молекулярной природы вещества.
ОСМОС
При разделении двух растворов различной концентрации полупроницаемой перегородкой возникает поток растворителя от меньшей концентрации к большей. Этот процесс называется осмосом.
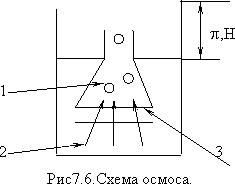
1 - сосуд с раствором, 2 - емкость с чистой жидкостью, 3 -полупроницаемая перегородка (мембрана).
Методи визначення молекулярної маси полімерів за властивостями розчинів
Найбільш часто середнечисельну молекулярну масу полімерів знаходять методом осмотичного тиску, який заснований на вивченні явища осмосу - одностороннього проникнення молекул розчинника через напівпроникну мембрану, що не пропускає молекули полімеру. Кількісної характеристикою явища осмосу служить осмотичний тиск, пропорційне числу молекул в одиниці об'єму розчину.
Молекулярна маса визначається як коефіцієнт, що зв'язує вагову і часткову концентрації
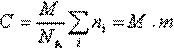 де С – вагова концентрація, г/см3;
де С – вагова концентрація, г/см3;

Таким чином, завдання зводиться до визначення мольної концентрації розчину відомої вагової концентрації.
Прагнення молекул розчинника до мимовільного проникненню через мембрану визначається різницею хімічних потенціалів розчинника в частинах системи, розділених перегородкою

де – парціальний молярний об'єм розчинника, м - служить кількісною мірою спорідненості між компонентами розчину.
Зв'язок між осмотичним тиском і ваговій концентрацією розчинів описується наступними рівняннями:
(рівняння Вант-Гоффа) для розчинів низькомолекулярних речовин
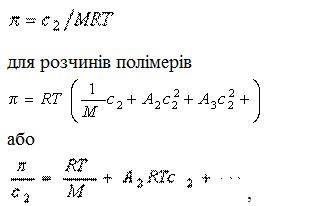
Дата добавления: 2015-08-17; просмотров: 69 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Електрокінетичні явища в колоїдних розчинах | | | СЕДИМЕНТАЦИЯ |