
Читайте также:
|
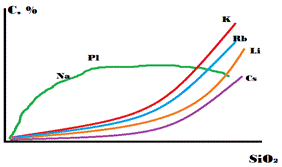
Группа щелочных металлов представлена: Li, Na, K, Rb, Cs, в этом ряду увеличивается ионный радиус, но распространённость уменьшается (Li исключение). Ионные радиусы в ангстремах: Li (0.78), Na (0.98), K (1.33), Rb (1.49), Cs (1.65), содержание в хондритах в %: Li (10^-4), Na (1), K (0.1), Rb (10^-4), Cs (10^-5). Все элементы кроме Li образуют ионные связи. Li образует ионную с долей ковалентной. Изоморфизм связывает щелочные металлы и элементы второй группы: Li-Mg, Na-Ca, K-Sr, Rb-Ba (из-за сходства ионных радиусов. В самой же группе щелочные металлы плохо замещают друг друга), но основной изоморфизм в группе K-Rb (сам изоморфизм из-за лантаноидного сжатия), поскольку рубидий менее распространён его геохимия подчинена геохимии калия. Все элементы группы - литофилы, имеет высокое сродство к кислороду и обогащают земную кору. В магматическом процессе накапливается в основных породах только натрий, остальные не когерентные. Цезий имеет большой радиус, не имеет изоморфных аналогов - поэтому у него собственная геохимия. Все элементы группы (кроме натрия) накапливаются в пегматитах. Переносятся растворами в ионной форме. Абсорбируются по закону: с увеличением заряда и ионного радиуса абсорбция увеличивается. Соответственно, способность к абсорбции увеличивается от Na к Cs. Li же почти амфотерный элемент (все остальные типичные катионы) и образует гидратную оболочку. В такой форме он абсорбируется сильнее Na.
2 изотопа 6Li-7.5%; 7Li-92.5%
Литий в ходит в пироксены, амфиболы, слюды, т.е. в минералы магния. Сам литий имеет 98 минералов (основные: сподумен, эльбаит). Рассеивается пока магния много, но когда Mg кончается, обогащает граниты. Накапливается в пегматитах. Хорошо переносится водными растворами в ионной форме. Чтобы литий накапливался необходимо чтобы был дифференцированные гранитный расплав с маленьким содержанием магния.Сорбируется, образуя в водных растворах комплекс. Изотопы по разному поглащают нейтроны. Шестой - 500 барн, 7 - 0.7 барн). Это используется в ядерных реакторах и водородных бомбах (шестой литий - поглощение n, седьмой - теплоноситель). Стандарт Li - НИСТ - просто реактив, Li из соленых озер континентальной ветви. Почти все минералы лития находятся в пегматитах. В основном магматизме рассеивается в минералах магния. В кислых магматических породах накапливается (Li-F граниты), приводит к образованию редкометальных месторождений - возникает ликвация между силикатным и силикатно-фтористым расплавом, литий расширяет поле устойчивости этого расплава. Расплав концентрирует редкие земли. В гидротермальных процессах выщелачивается образуя хлориты обогащенные Li (редко) или выносится. Выносится при выветривании пород, сорбируется на взвеси. Содержание Li в континентальной коре (20 мг/кг) > содержания в морской воде (0.15 мг/л)Li - биофильный элемент. Живые организмы поглощают его (хотя функция лития в живом организме пока не известна). Людям нужен для создания батареек (легкий, поэтому используют его, а не K, Rb и т.д.). Источник лития для промышленности - рапа содовых озер континентальной ветви.
Натрий, один стабильный изотоп - 23. радиоактивный - 22 Na, Т=2 года (по количеству этого изотопа узнают возраст космических тел). Всего у натрия 781 минерал. Сульфиды натрия найдены в метеоритах (NaFeS2), наиболее частые минералы - полевые шпаты, силикаты и алюмосиликаты, нефелин, щелочные пироксены и амфиболы. В листовые силикаты натрий входит хуже (паргасит NaCa2(Mg4Al)[Si6Al2O22](OH)2), фосфаты редки, оксидов нет. Может встречаться в условиях мантии. В магматическом процессе натрий и калий вместе (в плагиоклаз). Na концентрируется в средних или щелочных породах. В гипергенных процессах натрий уже не похож на кальций, образует NaCl. Для натрия большую роль в гипергенных процессах играет галогенез. Галогенез -процессы формирования испарением рассолов в поверхностных бассейнах аридной зоны, осаждения из них и образования отложений легкорастворимых солей (морская вода не насыщена Na, поэтому нужен галогенез для его осаждения). Обычный порядок галогенеза: гипс -> ангидрит - > галит - > сильвин. Главный минерал натрия в осадочных породах - галит (NaCl). натрия в осадочных породах меньше, чем в магматических. Максимум натрия обнаруживается в щелочных и основных породах, там присутствует большое количество анортита. В экзогенных процессах натрий подвижный в водных растворах. В целом, ионный состав континентальных вод определяется растворимостью плагиоклаза. Натрий плохо сорбируется на глинах. Но может быть удержан альбитизацией. Гальмиролиз - подводное выветривание, химико-минералогическое преобразование первичного осадка на дне моря под влиянием процессов растворения, окисления и др. Г. объясняют происхождение некоторых минералов, возникающих только в морских осадках (глауконит, шамозит и др.). Натрий важнейший элемент жизни. Создает электролиты в организме, внутреклеточная жидкость не похожа на морскую воду, в отличии от электролитов, поэтому много натрия смертельно. При отделении летучих компонентов от расплава, может возникнуть солевой (хлоридный) расплав - существенное значение для месторождений.
Калий. Имеет несколько сотен минералов. Большинство редкие, встречающиеся в щелочных породах (сульфиды - мурунтит (Fe,K)S). Имеет три изотопа (в скобках количества в природной смеси) 39 (93.2581%), 40 (0.01667%), 41 (6.7302%). Из них радиоактивный сороковой, к настоящему времени распалось около 92%. На ранних этапах Земля выделяла большое количество тепла за счёт радиоактивности. Одним из важнейших компонентов был 40-й калий, который может распадаться бетта-распадом и к-захватом, получается 40-й кальций (89.5%) и 40-й аргон (10.5%) соответственно. Геотермический градиент был больше, Земля горячее. Калий - литофильный в метеоритном веществе. На Земле - не когерентный, накапливается в остаточном расплаве и, следовательно, концентрируется в земной коре. Распределение не равномерно, так базальты менее радиоактивный чем граниты или щелочные граниты. Так определяли из чего состоит поверхность Венеры, породы Венеры радиоактивны как базальты. Одним из старейших методов датирования является калий-аргоновый метод (применяется для осадочных пород), сейчас используют его модификацию аргон-аргоновый метод. Калий начинает кристаллизоваться с появлением КПШ и слюд - щелочные граниты и базальты может дойти до лейцита (K[AlSi2O8]). Калий хорошо подвижен в растворах в виде ионной формы. Хорошо сорбируется на глинах и слюдами, листовыми силикатами - что контролирует калий в природных водах. В морской воде содержится 0.04 промилле калия. Калийные соли появляются на поздних этапах сгущения морской воды (Приуралье, иркутский амфитеатр). Калийные соли - удобрения, биофильные, добываются как сырье. Калий важен для жизни - поддерживает баланс в электролитах и запускает протонные насосы. Так же, он лимитирует жизнь, поэтому для почв очень важны калийные удобрения, растения умеют растворять К-минералы. В метаморфическом процессе калий не перемещается, схватывается слюдами, потом КПШ.
Рубидий. Имеет два изотопа (в скобках количества в природной смеси): 85 (72.1650%) и 87 (27.835%), 87 - радиоактивный, период полураспада 4.8*10^(10) лет, на сегодняшний день распалось 6.28%. Поведение полностью зависит от К, не имеет собственной геохимии. У них очень схожие радиусы, но К распространен в 300 раз больше. Если вдруг так получилось, что Rb и K много, они начинают делить минералы ипоявляются минералы, обогащенные Rb. Рубидий не когерентный элемент, накапливается в в ходе кристаллической дифференциации. Максимум приходится на аляскитовые граниты. Легко выщелачивается. Рубидий лучше сорбируется чем калий, так отношение K:Rb в морской воде 3000. Рубидий не вносит значимый вклад в энергетику Земли. Есть рубидий - стронциевый метод датирования. Для него нужно строить изохрону. Эта пара очень зависима от метаморфизма, поэтому дает возраст последнего этапа.
Цезий. изотоп один 137 (т.е. цезий - моноизотоп). Правда, среди осколков деления урана есть антропогенный цезий. Он испытывает альфа-распад. T - несколько десятков лет. Собственных минералов 17 (авогадрит, поллуцит). Крупный, но одновалентный ион, поэтому нет изоморфизма. Кларк 6*10^(-4), что отличается от содержания в Сi. Это можно отметить по соотношению рубидий:цезий =12 для метеорита, =20 для земной коры. Цезий летучий - может переноситься в газовой фазе (эта характеристика улучшается от калий к цезию). Источником является авогадрит ((K,Cs)BF4) (типичный минерал для высокотемпературных возгонов). Хорошо сорбируется. обогащает самые последние расплавы, некогерентен. Если нет собственной истории, растворяется в минералах калия. Если много K и Cs, то происходит то же, что и с Rb.
Геохимия ванадия. Связь геохимии V с органическим веществом, нефтями, твердыми битумами. Ванадий и организмы. Состояния V в природе и основные химические и кристаллохимические свойства; типы соединений, изоморфные отношения.
Ванадий (23, 5 группа) - литофильный элемент. Переменной валентности. Валентности +3,+4,+5 - и все они встречаются в природе. +5 (ок.форма) - присутствует в форме комплексов VO4+, встречающихся в природе (хорошо мигрирует в воде). 3+(вост.ф) - встречается в эндогенных процессах (является гидролизатом, плохо мигрирует в воде). Геохимия ванадия связана с геохимией титана, но распространен он значительно меньше.
При выветривании ванадий легко окисляется. В виде пятивалентного легко мигрирует в природных водах, накапливается в океане. Таллософильный элемент. В виде соответствующих ионов: ванадате и осаждается глинами и гидрооксидами железа. Осадочные месторождения железных руд часто содержат значительные концентраци ванадия. Есть минерал сульфида фатронит VS2.
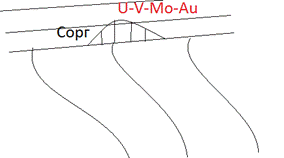
Накапливается на восстановительном геохимическом барьере. Месторождением типа несогласия. контакт меду породами метаморфическими фундамента и осадочными породами чехла.Присутсвует на ролловых месторождениях урана. Рассеивается на магматической стадии распределения Ti и Fe. Отношение Cr/V всегда резко падает при фракционировании. Возникают Ti-магнетитовые руды, локализация на поздней стдии магматическрого процесса и здесь как примесь появляется ванадий. ВОзникают титанито-магнетитовые ванадистые руды. добавление ванадия резко улучшают свойства стали. Шведские месторождения. шведская сталь природно лигированные железные руды.
Ванадий биофильный элемент. Переносчик кислорода. Ванадий накапливается в нефтях + и иридий. Является маркером в нефтях. Обогащение ванадием происходит из первичного органического вещества.
2 изотопа есть 51 общей картины нет.
Содержание 0,015%. V литофильный элемент. Два изотопа 50 (не стабильный, но период полураспада очень большой) и 51, данных по фракционированию нет. Ванадий имеет 4 степени окисления: 0, 3+, 4+ [VO(2+)], 5+[VO2(+), который легко переходит в ванадил-ион VO4(2-)]. Собственный геохимический путь только у пятивалентного ванадия, так как трехвалентный схож с железом и изоморфно с ним связан.
В магматическом процессе ванадий изоморфно входит в титаномагнетит в средних породах, замещая титан. Могут образовываться месторождения титаномагентита богатого ванадием – это основной источник ванадия для чёрной металлургии, помимо этого могут образовываться так природно-легированные железные руды.
При выветривании ванадий легко окисляется до ванадил-иона, который является хорошим мигрантом в природных водах. Может сорбироваться глинами и гидроксидами железа.
В гидротермальном процессе себя не проявляет. Поскольку +5 хорошо переносится в водах, а 3+ нет, то происходит накопление ванадия на восстановительных барьерах, т.е. накапливается в месторождения органики (зола нефтей) и месторождениях несогласия (под другому ролловые месторожедния, например урана). В золе нефтей (остаток от одной из стадий обработки нефти) содержится достаточное количество ванадия для нужд промышленности, зачастую другими месторождениями не пользуются. Ванадий может входить в органические парафины, наблюдается некоторая связь между ванадием и органическим веществом, является биомаркером. Естественно, биофильный, в некоторых организмах входит в белки.
Ванадий накапливается в океане.
Минералогия ванадия скудна, хоть и насчитывается около 160 минеральных фаз. Особо важно, наличие сульфида ванадия – патронита VS4 (с формулой спорно). Ещё один пример минерала – ванадинит Pb5[VO4]3Cl, относится к группе апатита.
Дата добавления: 2015-08-17; просмотров: 273 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Вторжение | | | Геохимия фтора. Летучие соединения. Роль в миграции других элементов. F и фосфаты пород. Молекула апатита. Биогеохимия фтора. |