
Читайте также:
|
ХИМИЧЕСКАЯ СВЯЗЬ
Основные типы и количественные характеристики химической связи
Химическая связь - взаимное притяжение атомов, приводящее к образованию молекул, ионов, радикалов, кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют Х. с. Валентность атома (о чём подробнее сказано ниже) показывает число связей, образуемых данным атомом с соседними атомами.
Все взаимодействия, приводящие к объединению частиц (атомов, молекул, ионов, радикалов) в вещества делятся на химические связи и межмолекулярные взаимодействия.
Основной причиной, определяющей образование химической связи является стремление системы, состоящей из отдельных атомов к понижению полной энергии.
В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую.
Основные характеристики химической связи:
1) энергия химической связи является мерой ее прочности.
Энергия связи — это энергия, выделяющаяся при образовании одного моля связей данного типа или энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества (количество связей равное числу Авогадро). Чаще всего энергию связи измеряют в кДж/моль. Наиболее прочными являются ионные и ковалентные связи, энергии этих связей составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. Об этом свидетельствуют, в частности, высокие температуры кипения металлов, например 357 °С (Hg), 880 °С (Na), 3000 ° С (Fe) и т. д. Так например, при образовании одного моля молекул водорода из атомов выделяется 435 кДж/ моль энергии. Такова энергия связи Н – Н. Такое же количество энергии необходимо затратить для того, чтобы превратить один моль молекул в атомы: Н2 = 2Н – 435 кДж/моль.
2 ) длина связи – расстояние между ядрами связанных атомов. Так в молекуле воды длина связей между атомом кислорода и атомами водорода составляет 0,096 нм (d (OH) = 0,096 нм), в молекуле аммиака длина связи между атомом азота и атомами водорода составляет 0,1015 нм.
3) Валентный угол или угол связи – угол между линиями двух связей одного и того же атома. Очевидно, что понятие валентного угла применимо только к молекулам (ионам, радикалам), содержащим три и более атомов в молекуле (ионе, радикале). Так, в молекуле воды угол связи составляет 104,50, в молекуле аммиака – 107,30:
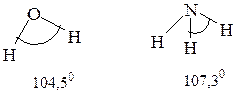
Важной характеристикой химической связи является ее кратность. Кратность связи определяется количеством электронных пар, связывающих два атома, например:
этан H3C–CH3 одинарная связь (σ-связь)
этилен H2C=CH2 двойная связь (одна σ-связь и одна π-связь)
ацетилен HC≡CH тройная связь (одна σ-связь и две π-связи).
С увеличением кратности возрастает энергия связи, однако это возрастание не пропорционально кратности, т.к. π-связи менее прочны, чем σ-связь.
Дата добавления: 2015-08-10; просмотров: 101 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ВЕРТИКАЛЬНАЯ УСТОЙЧИВОСТЬ ВОЗДУХА И БЕ ЗНАЧЕНИЕ | | | Ковалентной называется связь, которая образуется между двумя атомами за счет одной или нескольких общих электронных пар, одновременно принадлежащих им обоим. |