
Читайте также:
|
9.6.1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
01 – гидрокарбонатом натрия и гидроксидом натрия;
02 – гидроксидом хрома (III) и хлороводородной кислотой;
03 – силикатом калия и хлороводородной кислотой;
04 – гидроксидом цинка и гидроксидом натрия;
05 – сульфидом калия и хлороводородной кислотой;
06 – карбонатом бария и азотной кислотой;
07 – сульфатом железа (II) и сульфидом аммония;
08 – гидроксидом меди (II) и азотной кислотой;
09 – нитратом гидрооксоцинка и азотной кислотой;
10 – гидроксидом берилия и гидроксидом натрия;
11 – гидроксидом бария и хлоридом кобальта (II);
12 – сульфидом кадмия и хлороводородной кислотой;
13 – нитратом серебра и хроматом калия;
14 – гидроксидом олова (II) и хлороводородной кислотой;
15 – хлоридом аммония и гидроксидом бария;
16 – фтороводородной кислотой и гидроксидом калия;
17 – хлоридом железа (III) и гидроксидом калия;
18 – сульфатом меди (II) и сероводородной кислотой;
19 – хлоридом кальция и нитратом серебра;
20 – гидроксидом алюминия и серной кислотой;
21 – нитратом свинца (II) и иодидом калия;
22 – гидроксидом алюминия и гидроксидом натрия;
23 – сульфидом натрия и серной кислотой;
24 – карбонатом магния и азотной кислотой;
25 – сульфатом никеля (II) и гидроксидом натрия;
26 – гидроксидом аммония и иодоводородной кислотой;
27 – ацетатом натрия и хлороводородной кислотой;
28 – гидроксидом кобальта (II) и серной кислотой;
29 – гидрокарбонатом калия и гидроксидом калия;
30 – уксусной кислотой и гидроксидом натрия;
31 – хлоридом железа (III) и гидроксидом натрия;
32 – хлоридом железа (III) и гидроксидом аммония;
33 – азотной кислотой и гидроксидом бария;
34 – азотистой кислотой и гидроксидом стронция;
35 – бромидом бария и карбонатом калия;
36 – гидроксидом алюминия и хлороводородной кислотой;
37 – нитратом серебра и бромидом калия;
38 – гидроксидом хрома (III) и серной кислотой;
39 – нитратом серебра и ортофосфатом калия;
40 – фосфорной кислотой и гидроксидом калия;
41 – нитратом марганца (II) и гидроксидом натрия;
42 – гидроксидом аммония и хлороводородной кислотой;
43 – хлоридом олова (II) и гидроксидом натрия;
44 – хлороводородной кислотой и гидроксидом калия;
45 – нитратом железа (II) и ортофосфатом калия;
46 – сероводородной кислотой и гидроксидом натрия;
47 – ортофосфатом аммония и гидроксидом калия;
48 – гидроксидом аммония и бромоводородной кислотой;
49 – сульфатом хрома (III) и гидроксидом калия;
50 – гидроксидом железа (III) и азотной кислотой;
51 - бромидом алюминия и нитратом серебра;
52 – гидроксидом олова (II) и гидроксидом калия;
53 – нитратом цинка и гидроксидом натрия;
54 – гидроксидом аммония и серной кислотой;
55 – гидрокарбонатом натрия и гидроксидом натрия;
56 – бромидом железа (III) и гидроксидом аммония;
57 – гидроксидом аммония и сероводородной кислотой;
58 – сульфитом натрия и хлороводородной кислотой;
59 – ацетатом калия и бромоводородной кислотой;
60 – гидроксидом аммония и уксусной кислотой.
9.6.2. Составьте в молекулярной форме уравнения реакций, которые выражаются следующими краткими ионно-молекулярными уравнениями:
01 – Mg2+ + CO 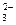 = MgCO3¯;
= MgCO3¯;
02 – Н+ + ОН¯ = Н2О;
03 – Cu2+ + S 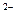 = CuS¯;
= CuS¯;
04 – SiO 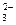 + 2H+ = H2SiO3;
+ 2H+ = H2SiO3;
05 – CaCO3¯ + 2H+ 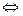 Ca2+ + H2O + CO2;
Ca2+ + H2O + CO2;
06 – Al(OH)3¯ + OH¯ Û [Al(OH)4] ¯;
07 – Pb2+ + 2I¯ = PbI2¯;
08 – Fe(OH)3¯ + 3H+ Û Fe3+ + 3H2O;
09 – Cd2+ + 2OH¯ = Cd(OH)2¯;
10 – Н+ + NO2¯ = HNO2;
11 – Zn2+ + H2S Û ZnS¯ + 2H+;
12 – Ag+ + Cl¯ = AgCl¯;
13 – HCO3¯ + H+ = H2O + CO2;
14 – Be(OH)2¯ + 2OH¯ Û [Be(OH)4]2-;
15 – СН3СОО¯ + Н+ = СН3СООН;
16 – Ва2+ + SO 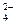 = BaSO4¯;
= BaSO4¯;
17 – СН3СООН + ОН¯ Û СН3СОО¯ + Н2О;
18 – SO 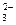 + 2H+ = H2SO3;
+ 2H+ = H2SO3;
19 – СО 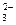 + 2Н+ = Н2О + СО2;
+ 2Н+ = Н2О + СО2;
20 – NH4OH + H+ Û NH4+ + H2O;
21 – HCN + OH¯ Û CN 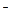 + H2O;
+ H2O;
22 – Ag+ + Br¯ = AgBr¯;
23 – Сr3+ + 3OH¯ = Cr(OH)3¯;
24 – 2ОН¯ + H2S Û 2H2O + S2;
25 – Fe3+ + 3OH¯ = Fe(OH)3¯;
26 – Са2+ + 2F¯ = CaF2¯;
27 – Sn(OH)2¯ + 2OH¯ Û [Sn(OH)4]2¯;
28 – 2Ag+ + CrO 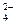 = Ag2CrO4¯;
= Ag2CrO4¯;
29 – H2Se + 2OH¯ Û 2H2O + Se 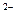 ;
;
30 – Al3+ + 3OH¯ = Al(OH)3¯.
Дата добавления: 2015-07-25; просмотров: 161 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гетерогенное равновесие | | | Гидролиз солей |