
Читайте также:
|
Существуют два способа культивирования микробных клеток: периодический и непрерывный. При периодическом способе культивирования осуществляется накопление как самой биомассы, так и продуктов метаболизма микроорганизмов. Культивирование, под которым понимается развитие популяции микробов в специальном аппарате, осуществляется большей частью с использованием жидких питательных сред. Схема и основные элементы конструкции типового культиватора для глубинного выращивания микробов представлены на рис. 2.
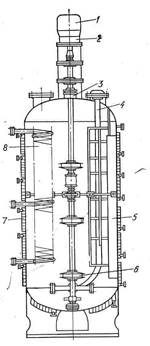
Рисунок 2 – Схема и основные элементы конструкции ферментера
Аппарат снабжен электродвигателем 1 и редуктором 2 для вращения вала, на котором установлена трехъярусная турбинная мешалка 6. Ввод вала перемешивающего устройства герметизирован с помощью торцового уплотнения 3. Отражательные перегородки 5 предотвращают вращательное движение культуральной жидкости и улучшают массообмен. Для отвода тепла, выделяющегося при культивировании и перемешивании мешалкой, предусмотрены теплообменные устройства в виде секционной рубашки 7 и змеевиков 8. Воздух на аэрацию подается через трубу 4, снабженную барботером.
Это так называемый глубинный или суспензионный метод культивирования. При изучении процесса развития популяции микробов основной наблюдаемой величиной является концентрация микроорганизмов.
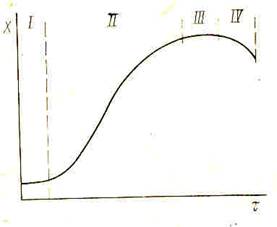
Рисунок 3 – Кривая роста популяции микробов при периодическом культивировании
Процессы роста и развития популяции микробов в периодически действующем аппарате протекают в несколько стадий. Типичная кривая изменения концентрации микробов X от времени τ приведена на рис. 3.
Кривая роста популяции микробов при периодическом культивировании.
S- образный характер этой кривой является универсальным и не зависит от вида микроба и условий культивирования.
Различают следующие основные стадии развития популяции микробов: начальную, рост, равновесие, отмирание.
В свою очередь каждая из этих стадий может быть разделена на несколько фаз. На первой стадии, которая начинается с посева в питательную среду, в первый момент может наблюдаться некоторое снижение концентраций микробов (латентная фаза - I). Затем содержание биомассы возрастает, сначала в результате роста только объема клеток, а затем и вследствие увеличения их количества (лагфаза и фаза ускорения роста - II). Стадия роста включает фазу экспоненциального (логарифмического - III) роста и фазу замедления роста. Затем наступает стадия равновесия (максимально стационарная фаза - IV) и отмирания (гибели) популяции, последняя представляет интерес в случаях, когда целевой продукт выделяется в результате разрушения (лизиса) клеток.
Н.Д.Иерусалимским была предложена математическая модель зависимости коэффициента скорости роста от концентрации продуктов обмена, которая описывает S-образную кривую роста:
S Kp
μ = μ max ..--------- ..-------------- (4)
Ks + S Kp + P
где: S- концентрация субстрата, кг/м3;
КS- константа насыщения, кг/м3;
μ мах - максимально удельная скорость роста, ч-1;
Р – концентрация ингибирующего продукта обмена в культуральной жидкости, кг/м3;
Кр – константа, кг/м3.
Физический смысл константы Кр заключается в том, что Кр= Р при μ =0,5 μ мах, т. е. Кр – это такая концентрация ингибирующего продукта, при которой в условиях высокой концентрации субстрата удельная скорость роста достигает половины своего максимального значения.
Некоторые микробы лучше развиваются на плотных питательных средах и такой метод культивирования, называется поверхностным. Поверхностный метод менее технологичен и применяется в исключительных случаях, когда нельзя воспользоваться глубинным методом.
При непрерывном способе культивирования требуется глубокое знание процесса и его кинетики. При непрерывных процессах больше возможностей для специализации аппаратуры на отдельных стадиях технологии и контроля качества продукта. Кроме того, в аппаратах полного смешения возможно сохранять постоянными параметры процесса и тем самым стабилизировать культуру в желательном для производства физиологическом состоянии.
Условия культивирования микробов в непрерывно действующем аппарате более благоприятны, чем в периодическом. В первом случае среда все время обновляется, поэтому не наблюдается изменений концентрации веществ в результате жизнедеятельности микробов. Поток среды отрегулирован так, что концентрации веществ, биомассы и продуктов обмена поддерживаются постоянными.
2. СОДЕРЖАНИЕ ПРАКТИЧЕСКОГО ЗАНЯТИЯ.
ЦЕЛИ ЗАНЯТИЯ
1.Познакомиться со способами стерилизации питательных сред.
2.Изучить порядок подготовки оборудования к работе.
3.Освоить технологию получения нативных культур колибактерина на основе шт. М-17.
4.Изучить порядок завершения выполнения работ на стадии.
СЫРЬЕ, МАТЕРИАЛЫ, РЕАКТИВЫ И ОБОРУДОВАНИЕ
К РАБОТАМ ПО ПРИГОТОВЛЕНИЮ ПОСЕВНЫХ И НАТИВНЫХ КУЛЬТУР
Сырье:
Мясо-пептонный бульон РП-153-80
Питательный агар РП-153-80
Среда Эндо РП-153-80
Мясо-пептонный агар РП-153-80
Казеиновый или дрожжевой питательный агар РП-153-80
Среда высушивания РП-153-80
Натрий хлористый ГОСТ 4233
Натрий двууглекислый ГОСТ 2156
Натрий фосфорнокислый 2-х зам. ГОСТ 4172
Реактивы:
Натрия гидроокись, ГОСТ 4328
Фуксин основной, ГОСТ 1738
Йод кристаллический, ГОСТ 4159
Калий двухромовый, ГОСТ 4220
Генциан-виолет, ТУ 6-09-945-76
Фенолфталеин, ТУ 6-09-5360
Спирт этиловый, ГОСТ 5962
Вода дистиллированная, ГОСТ 6709
Глицерин дистиллированный, ГОСТ 6824
Калий йодистый, ГОСТ 4232-74
Метиловый фиолетовый (метилвиолет), ТУ 6-09-945-76, чда.
Посуда:
Пробирки, ГОСТ 25336
Чашки Петри, ГОСТ 25336
Матрацы стеклянные, ТУ 64-2-181
Флаконы, вместимостью 100 дм3, ТУ 64-2-100
Колбы конические лабораторные, вместимостью, 100, 250см3, ГОСТ25336
Ступка и пестик фарфоровые, ГОСТ 9147
Материалы:
Вата медицинская гигроскопическая, ГОСТ 5556
Марля медицинская, ГОСТ 9412
Бумага фильтровальная лабораторная, ГОСТ 12026
Пробки ватно-марлевые лабораторного изготовления
Масло иммерсионное СТУ 21-413
Халат медицинский
Тапочки госпитальные
Респиратор «Лепесток-200»
Перчатки хирургические
Шапочка медицинская
Оборудование:
Ферментер лабораторный, V=1,5л; V=5,0л
Насос вакуумный
Автоклав, ГОСТ 14106
Микроскоп световой биологический, ГОСТ 8284-78
Ход работы
ПОДГОТОВКА ОБОРУДОВАНИЯ (ФЕРМЕНТЕРА)
К РАБОТЕ
Подготовка ферментера включает в себя выполнение следующих операций:
ревизию всей запорной арматуры;
проверку целостности уплотнительной прокладки на крышке аппарата;
проверку наличия заземления;
проверку исправности приборов измерения температуры, рН.
ПРИЕМ ПИТАТЕЛЬНОЙ СРЕДЫ И ЕЕ СТЕРИЛИЗАЦИЯ.
Жидкую питательную среду (ЖПС) заливают в ферментер через крышку в количестве 1/2 …2/3 его полного обьема. В ферментер монтируют все необходимые датчики (температура, рН).
Питательную среду вместе с ферментером стерилизуют в автоклаве при температуре 121…123оС в течение 25…30 мин.
ЗАСЕВ МАТОЧНОЙ КУЛЬТУРЫ.
После стерилизации питательной среды ферментер устанавливают на пульт управления, производят все необходимые соединения (вода, сжатый воздух, вакуум). Берут пробу ЖПС для определения стерильности, рН с соблюдением правил асептики.
Затем в ферментер засевают с соблюдением правил асептики маточную культуру. Плотность посева должна составлять 400…600 млн микробных клеток в 1 мл среды.
В качестве пеногасителя используется растительное масло из расчета 1,5…3 мл на 1 л среды. Содержание ферментера перемешивают в течение 5 мин. и отбирают пробу с соблюдением правил асептики. В пробе контролируют:
отсутствие посторонних микробов;
плотность посева (по стандарту ГИСК);
количество живых клеток в 1 мл;
рН среды культивирования (при помощи рН-метра).
ВЫРАЩИВАНИЕ ПРОИЗВОДСТВЕННОЙ КУЛЬТУРЫ.
Выращивание микробов E.coli штамма М-17 производят в ферментере по следующему режиму:
температура – (37±1)оС;
перемешивание (частота вращения мешалки) – 600…1000 об/мин;
аэрация – 1…2 л/мин на 1 л среды.
В процессе культивирования в ферментер добавляют 40% раствор глюкозы в зависимости от рН среды, который должен быть в пределах 7,4…7,6 ед. рН в начале выращивания и 7,8…8,0 ед. рН в конце выращивания. При этом не допускается резких колебаний значений рН.
Каждый час из ферментера отбирают пробы для контроля:
рН среды (при помощи рН-метра, при отсутствии датчика рН);
густоты микробной взвеси.
В последней пробе контролируют дополнительно:
количество живых микробов (высев на агар в чашках Петри);
наличие посторонних микробов (микроскопией мазков, окрашенных по Граму).
Дата добавления: 2015-07-25; просмотров: 192 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Киров 2005 | | | МЕТОДИКИ КОНТРОЛЯ КАЧЕСТВА |